0 引 言
随着现代工业的飞速发展,铬及其化合物在工业中被广泛应用,产生大量含铬废水、废渣,导致铬污染程度不断加剧。Cr(Ⅵ)是具有强致突变作用的吞入性毒物和吸入性极毒物,其毒性比Cr(Ⅲ)高约100倍[1]。Cr(Ⅵ)以阴离子的形态存在,一般不易被土壤所吸附,具有较高的活性[2],是土壤污染的常见污染因子,可通过微生物还原、生物吸附和富集等方法降低其毒性和生物可利用性。
日益突出的Cr(Ⅵ)土壤污染问题逐渐引起全世界的广泛关注,国内外学者已对土壤中Cr(Ⅵ)的迁移转化规律进行了广泛研究。Krishna等[3]设计了一套柱式土壤修复反应系统,该系统由Cr(Ⅵ)浸提柱、解毒反应器和Cr(Ⅲ)吸附柱3部分组成,在该系统反应过程中发生了由Cr(Ⅵ)到Cr(Ⅲ)的迁移转化。张聪慧等[4]探究了复合土体中Cr(Ⅵ)在寒区低温环境中的迁移规律,即Cr(Ⅵ)含量均是低温端高于高温端,且中心位置浓度低于两侧边缘浓度,以及Cr(Ⅵ)自未冻区向增长着冰透镜体处迁移。王成文等[5]研究发现,酸性土壤对Cr具有良好的吸附性,在氧化条件下Cr(Ⅵ)迁移性最强,在还原条件下Cr(Ⅵ)转化为Cr(Ⅲ)的量最多。张蕊[6]通过动态土柱模拟方法研究Cr(Ⅵ)迁移转化的影响因素,研究发现,随着土壤中有机质含量的增多,淋溶液Cr(Ⅵ)浓度逐渐降低,但是当有机质含量增至一定程度时,Cr(Ⅵ)的减小趋势不明显,表明有机质对Cr(Ⅵ)转化为Cr(Ⅲ)有一定的作用。土壤微生物是土壤中物质转化的动力,国内外也不乏关于土壤微生物对Cr(Ⅵ)还原的研究。魏蓝[7]利用从重金属污染区域中筛选分离得到的高效还原菌,考察菌体还原土壤中Cr(Ⅵ)的影响因素及稳定化效果,发现Cr(Ⅵ)含量越高,同等时间下菌株的还原率越低,达到平衡所需时间越长,在土壤Cr(Ⅵ)含量为100 mg/kg时,菌株能发挥其最强还原能力;菌浓度越大,Cr(Ⅵ)全部还原所需时间越短。苏长青等[8]对好氧条件下铬污染土壤中Cr(Ⅵ)的土著微生物还原进行研究,结果表明,土著微生物对Cr(Ⅵ)还原有一定的作用,并提出Cr(Ⅵ)还原过程可分为2个阶段,分别以生物还原作用的指数方程模型和主要离子综合效应的线性方程模型为特征,认为土著Cr(Ⅵ)还原菌在Cr(Ⅵ)污染土壤的原位修复中具有潜在的应用前景。 芽孢杆菌在环境中分布广泛,具有耐高温、复活速度快和分泌酶能力强等特点,对外界有害因子抵抗力强。已有研究发现蜡样芽孢杆菌[9,10]、解淀粉芽孢杆菌[11]等芽孢杆菌属菌种能将Cr(Ⅵ)还原为Cr(Ⅲ),并且具有一定的Cr(Ⅵ)耐受性。
已有的关于土壤中Cr(Ⅵ)转化规律的研究大多集中于Cr(Ⅵ)在土壤中的化学转化[12,13],关于利用还原性微生物对土壤中Cr(Ⅵ)还原的研究也多集中于单一微生物[14-16],鲜有研究涉及利用混合微生物对土壤中Cr(Ⅵ)进行还原[17,18]。本研究采用土柱淋滤实验研究在混合芽孢杆菌作用下以及仅存在土著微生物时土壤中水溶态Cr(Ⅵ)的迁移和转化规律,并通过多种条件变量来探究混合芽孢杆菌对土壤中水溶态Cr(Ⅵ)的迁移和转化过程的影响,为开发更高效经济的土壤Cr(Ⅵ)污染修复技术手段提供参考。
1 材料与方法
1.1 实验土样分析
1.1.1 土壤样品的预处理
实验用土取自四川省成都市双流区,土壤类型为壤土。土壤样品经风干后,剔除土壤以外的侵入体,如动植物残体、砖头、石块等,再用圆木棍将土样碾碎。用四分法分取适量样品,使样品全部通过0.95 mm孔径的试验筛。混合均匀,置于洁净、干燥的密闭容器中保存。
1.1.2 样品理化性质的测定
1)土壤pH值的测定。取10.00 g土样置于50 mL的高型烧杯中,并加入25 mL水。将容器密封后,用振荡机或搅拌器,剧烈振荡或搅拌5 min,静置2 h。校正pH计,在搅拌的条件下,将电极插入样品溶液中,待读数稳定后读取pH。
2)土壤有机质含量的测定。土壤有机质的测定采用NY/T 1121.6—2016土壤有机质的测定中重铬酸钾容量法-油浴法[19],即用定量的重铬酸钾-硫酸溶液,在电加热条件下,使土壤中的有机质氧化,剩余的重铬酸钾用硫酸亚铁标准溶液滴定,并以SiO2为添加剂作实际空白标定,根据氧化前后氧化剂质量差值,计算出有机碳量,再乘以系数1.724,即为土壤有机质含量。
1.2 土柱实验方法
1.2.1 土柱装填
采用长为33 cm,内径为5.5 cm的有机玻璃柱,每个柱体侧壁分别有4个直径为5 mm的小孔供取样。取样孔用ABS实心棒封口,减少因取样造成土柱结构破坏。土柱底部用纱布固定。将质量分数为2.5%的混合芽孢杆菌菌液喷雾到土样中,混合均匀,土样按1.40 kg/L的干容重均匀地填充到有机玻璃柱至25 cm处,制成混合芽孢杆菌组土柱。对照组土柱填充采用不加菌液的土样。土柱名称及编号如表1所示。
表1 土柱名称及编号
Table 1 List of soil columns names

土柱名称编号未淋滤铬酸钾的对照组土柱0-D淋滤铬酸钾浓度为35mg/L的对照组土柱35-D淋滤铬酸钾浓度为70mg/L的对照组土柱70-D淋滤铬酸钾浓度为105mg/L的对照组土柱105-D淋滤铬酸钾浓度为140mg/L的对照组土柱140-D淋滤铬酸钾浓度为175mg/L的对照组土柱175-D未淋滤铬酸钾的混合芽孢杆菌组土柱0-H淋滤铬酸钾浓度为35mg/L的混合芽孢杆菌组土柱35-H淋滤铬酸钾浓度为70mg/L的混合芽孢杆菌组土柱70-H淋滤铬酸钾浓度为105mg/L的混合芽孢杆菌组土柱105-H淋滤铬酸钾浓度为140mg/L的混合芽孢杆菌组土柱140-H淋滤铬酸钾浓度为175mg/L的混合芽孢杆菌组土柱175-H
1.2.2 土柱淋洗
实验开始时,将土柱放于盛有去离子水的盘中,吸水24 h,至土柱在室温下饱和。分别配制0.6 L的35,70,105,140,175 mg/L的铬酸钾溶液,每一浓度溶液用于淋洗混合芽孢杆菌组与对照组2个土柱。实验中采用蠕动泵控制溶液流速为60 mL/h,铬酸钾溶液分2次淋洗,间隔6 h,每个土柱每次进液0.15 L。
1.2.3 土壤中水溶态Cr(Ⅵ)及滤出液中Cr(Ⅵ)含量测定
依次在淋洗后10,20,30 d的土柱中分别取距离土壤表面5,10,15,20 cm深度处的土样3.00 g。在105 ℃下烘40 min。Burton等[20]在研究铁氧体型土壤中Cr(Ⅵ)形成与加热温度的关系时,发现加热到200 ℃时在土壤中没有出现Cr(Ⅲ)氧化形成Cr(Ⅵ)的现象,即烘干过程不会影响土样中原有Cr的价态。向1.60 g的烘干土壤样品中加入8.00 mL去离子水,在3000 r/min的条件下振荡1 h,振荡后离心20 min,取离心后的上清液,采用GB 7467—87《水质 三价铬的测定二苯碳酰二肼分光光度法》测定土样中水溶态Cr(Ⅵ)浓度[21]。
采用上述处理方法测定原始土样中水溶态Cr(Ⅵ)含量。依次在加入铬酸钾溶液10,20,30 d分别收集滤出液20 mL,过滤后采用GB 7467—87测定滤出液中Cr(Ⅵ)浓度[21]。
1.2.4 土样中微生物分析
采集加入铬酸钾溶液30 d的3个土样和1个原始土样,即175-D、175-H、70-H、0-D土柱5 cm深度的土壤。样品采集后于-18 ℃保存。通过16S rRNA测序分析土壤中微生物群落结构,对比实验组和对照组土壤微生物群落结构的变化,获取土样中的物种丰富度及优势菌种[22-25]。
2 结果与讨论
2.1 土壤样品的理化性质
土壤样品的pH为8.26,有机质含量为8.6937 g/kg,水溶态Cr(Ⅵ)浓度为0.0674 mg/kg。
2.2 水溶态Cr(Ⅵ)在土柱中的剖面变化规律
2.2.1 对照组土样
水溶态Cr(Ⅵ)随着土壤中水分的运动而发生迁移现象,同时自身浓度在不同时期也会随着迁移而呈现不同的变化规律(图1)。在水溶态Cr(Ⅵ)的迁移过程中,还会发生被土壤胶体、有机质吸附或被土著微生物还原成生物毒性较小的Cr(Ⅲ)的转化过程[26]。故土壤中水溶态Cr(Ⅵ)的迁移和转化同时发生。

![]() Day 10;
Day 10; ![]() Day 20;
Day 20; ![]() Day 30。
Day 30。
图1 对照组土柱水溶态Cr(Ⅵ)浓度变化对比
Figure 1 Comparison of the water-soluble Cr(Ⅵ) concentration in the soil column of the control group
Cr(Ⅲ)易于被土壤吸附固定,形成Cr(OH)3沉淀,难以进行迁移;而Cr(Ⅵ)活性高,不易被土壤胶体吸附,迁移能力强[27]。壤土对铬存在滞留效应[28],将相应实验组与对照组的结果对比分析,即可得出水分等因素对铬迁移的影响。与对照组水溶态Cr(Ⅵ)浓度相比,铬酸钾溶液淋滤进入土柱后,实验组土壤中水溶态Cr(Ⅵ)浓度的迅速上升,随着时间推移,水溶态Cr(Ⅵ)迅速向下迁移,在土柱剖面上呈现出随着土壤深度增加水溶态Cr(Ⅵ)递减的趋势。在迁移的同时,水溶态Cr(Ⅵ)可能向其他存在形式转化。
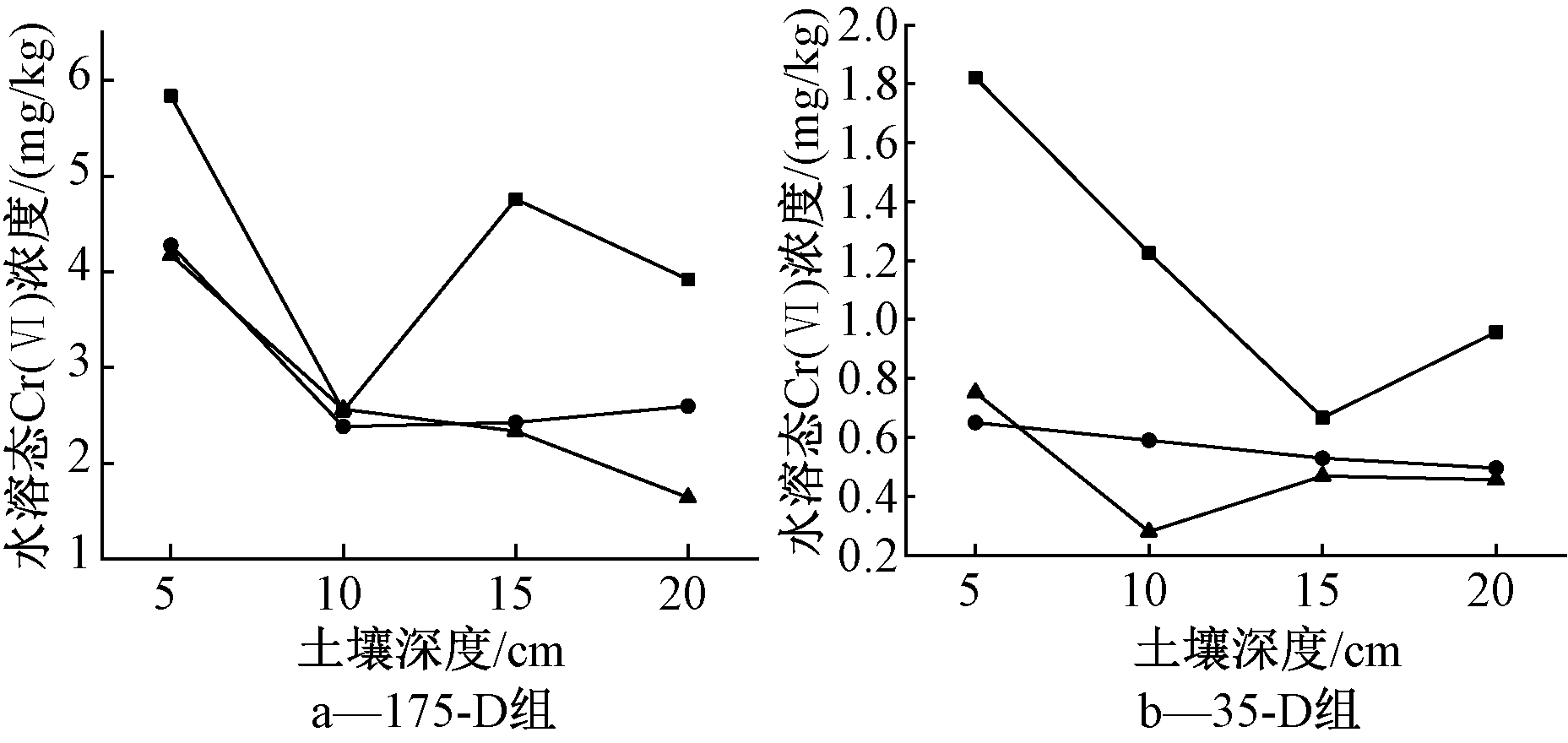
图2a为土壤中水溶态Cr(Ⅵ)浓度变化。可知:第10天取样时大量水溶态Cr(Ⅵ)随着水分迁移至15~20 cm深度,同时已有少量水溶态Cr(Ⅵ)迁移至土柱底部,土柱底部滤液收集池中也有渗滤液积累;第20天土壤水溶态Cr(Ⅵ)浓度在15~20 cm深度处呈下降趋势,并且15~20 cm与10 cm处浓度差异较小,第20天水溶态Cr(Ⅵ)浓度整体小于第10天的;第30天取样时水溶态Cr(Ⅵ)浓度呈现出随着土壤深度增加浓度下降的趋势,第30天与第20天间整体浓度差异小于第20天与第10天间,说明存在水溶态Cr(Ⅵ)前期(0~10 d)迁移速率明显高于后期迁移速率的现象,是由于土柱中土壤的水分迁移动力降低造成的[29,30]。铬酸钾溶液进入土柱造成水溶态Cr(Ⅵ)浓度发生剧烈变化,且原有土水势也发生了变化,使土柱中的土壤水分发生了向下压力传递迁移的现象。而土柱上端无外源水分补充,水分迁移动力会随着时间推移而日益降低,对土壤中水溶态Cr(Ⅵ)的迁移有直接的影响作用。水溶态Cr(Ⅵ)的迁移是质点的迁移,即当加灌的含Cr(Ⅵ)模拟污水迁移至该点,才会引起该点水溶态Cr(Ⅵ)浓度的变化,这一迁移规律使水溶态Cr(Ⅵ)前期迁移速率明显高于后期。
![]() —Day 10;
—Day 10; ![]() —Day 20;
—Day 20; ![]() —Day 30。
—Day 30。
图2 175-D组与35-D组土柱水溶态Cr(Ⅵ)浓度剖面变化
Figure 2 Variation of water-soluble Cr(Ⅵ) concentrations in soil columns of 175-D and 35-D
图2b为35-D组土柱中土壤的水溶态Cr(Ⅵ)浓度变化。与图2a对比可知:在加灌含Cr(Ⅵ)浓度分别为35,175 mg/L的溶液条件下,水溶态Cr(Ⅵ)在土柱中迁移呈现出不同的变化规律。第10天取样时,35-D组土柱中水溶态Cr(Ⅵ)随着水分迁移至土柱底部,175-D组土柱中大量水溶态Cr(Ⅵ)随着水分迁移至15~20 cm深度。在较低浓度条件下,水溶态Cr(Ⅵ)在土壤中的迁移速率高于较高浓度条件下,根据已有关于土壤中溶质迁移规律研究基础分析[29,30],这一现象与土壤中水分传递迁移动力有关,在较高浓度的溶液中溶质的迁移所需的传递迁移动力要高于在较低浓度的溶液中溶质的迁移。在忽略浓度差异引起的水分含量差异条件下,当土柱中总水分提供的传递动力一定时,较低浓度条件下水溶态Cr(Ⅵ)在土壤中的迁移速率高于较高浓度条件。
2.2.2 混合芽孢杆菌的土样
土壤中水溶态Cr(Ⅵ)的迁移会受到多方面因素的影响,其中包括土壤中微生物对重金属离子迁移的影响。加入混合芽孢杆菌的土样与对照土样相比,水溶态Cr(Ⅵ)在剖面上的浓度变化存在显著差异(图3)。
![]() Day 10;
Day 10; ![]() Day 20;
Day 20; ![]() Day 30。
Day 30。
图3 混合芽孢杆菌组土柱水溶态Cr(Ⅵ)浓度变化对比
Figure 3 Comparison of the water-soluble Cr(Ⅵ) concentration in the soil column of the mixed Bacillus group
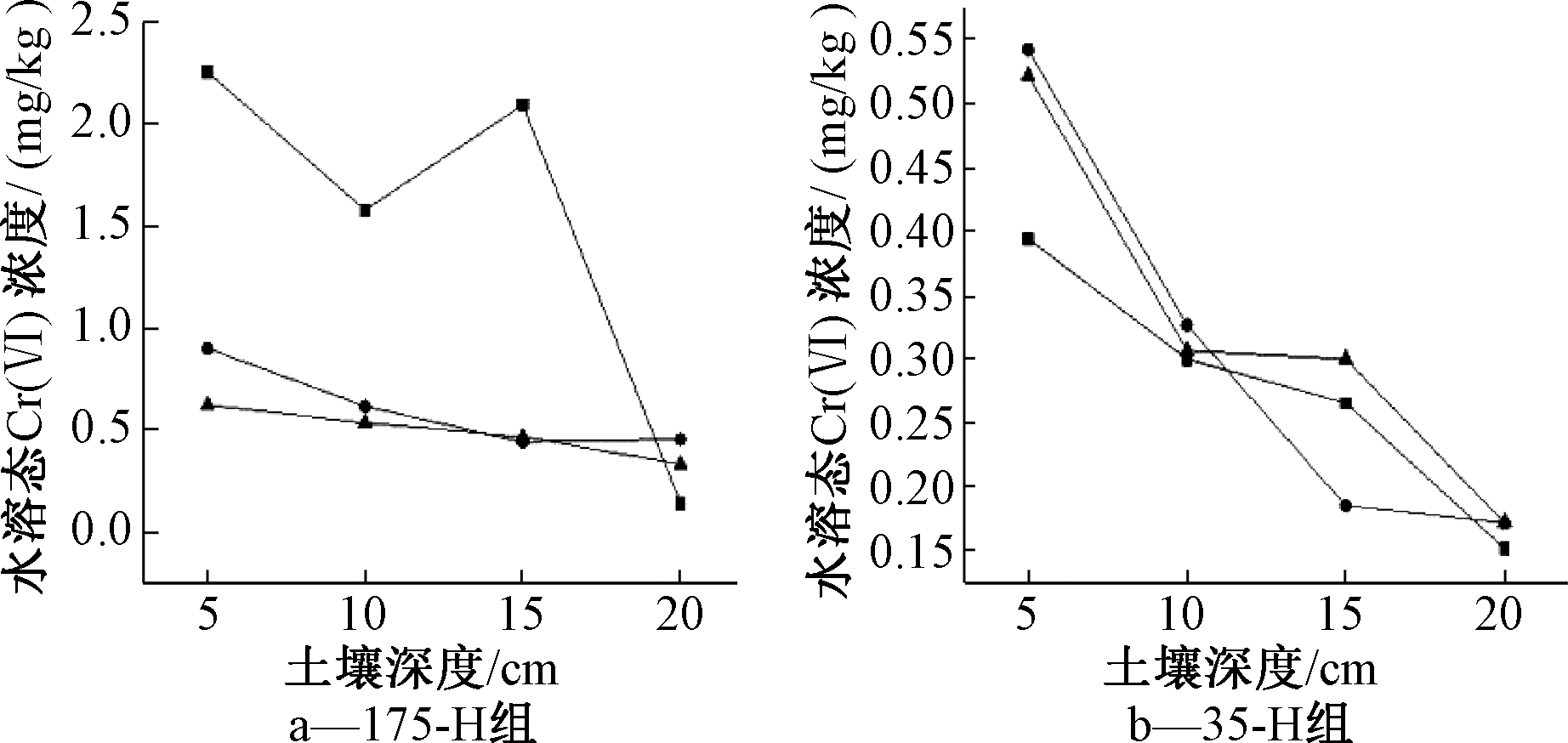
以175-D组(图2a)与175-H组(图4a)土柱为例,在第10天取样时,175-D组土柱中大量水溶态Cr(Ⅵ)随着水分迁移至15~20 cm深度,175-H组土柱中水溶态Cr(Ⅵ)随着水分迁移至10~15 cm深度,表明混合芽孢杆菌对土壤中水溶态Cr(Ⅵ)的迁移可能具有一定程度的阻碍作用。已有对细菌和真菌去除Cr(Ⅵ)机理的研究[10],结果显示,微生物可以通过细胞积累、细胞外还原、吸附、细胞内还原、盐释放、酶促反应和外排机制,或者通过抗氧化酶清除Cr(Ⅵ)。此外,由于混合芽孢杆菌在土壤中有充当活性胶体的功能,其拥有比表面积大、带电荷、代谢活动旺盛的特点,可以通过代谢等过程将土壤中Cr(Ⅵ)沉淀或轻度螯合在可溶或不溶性的生物多聚体上。
![]() —Day 10;
—Day 10; ![]() —Day 20;
—Day 20; ![]() —Day 30。
—Day 30。
图4 175-H与35-H组土柱中水溶态Cr(Ⅵ)浓度剖面变化对比
Figure 4 Comparison of profile changes of water-soluble Cr(Ⅵ) concentration in soil columns of 175-H and 35-H
对比175-H组土柱第20天和第30天的2次取样结果表明,在土柱剖面上土壤中水溶态Cr(Ⅵ)浓度随着土壤深度增加而下降,且下降幅度较小,曲线较为平缓。对比175-D组土柱在第20天和第30天取样结果,发现其在这2个时间点上的曲线下降趋势大于175-H组土柱。可知:混合芽孢杆菌在实验中后期对土壤中水溶态Cr(Ⅵ)的迁移影响较小,对比前期实验结果可知,混合芽孢杆菌对水溶态Cr(Ⅵ)迁移的影响集中于前期,这是因为混合芽孢杆菌对土壤中Cr(Ⅵ)具有较强的沉淀及还原作用。并且在相关研究中也发现,芽孢杆菌属对Cr(Ⅵ)具有良好的还原能力[9-11]。在混合芽孢杆菌作用下,前期土壤中水溶态Cr(Ⅵ)浓度降低,至中后期,土壤中水溶态Cr(Ⅵ)浓度已降至较低水平,故混合芽孢杆菌在中后期对水溶态Cr(Ⅵ)影响不明显。
2.3 微生物作用下土壤中水溶态Cr(Ⅵ)的转化
土壤中的Cr(Ⅵ)主要存在3种转化方式:通过氧化、还原作用与溶液中Cr(Ⅲ)进行相互转化;通过吸附、解吸与土壤胶体Cr(Ⅵ)进行相互转化;通过沉淀、溶解与难溶态Cr(Ⅵ)的难溶物进行相互转化。在自然无干扰条件下,土壤中Cr(Ⅵ)的3种转化作用处于动态平衡状态[26]。
随着时间的推移,对照组各取样点土样中水溶态Cr(Ⅵ)浓度均降低(图1),虽然外来含Cr(Ⅵ)溶液的加入破坏了自然状况下土壤中Cr(Ⅵ)的转化平衡,但土壤本身具有一定的自净能力,如某些土著微生物能将Cr(Ⅵ)还原为Cr(Ⅲ),因此土壤中Cr(Ⅵ)浓度仍能在土壤自身的缓冲调节作用下有较小程度的降低。
与对照组相比,混合芽孢杆菌组各深度土样中的水溶态Cr(Ⅵ)浓度都显著降低(图4a)。除了混合芽孢杆菌对Cr(Ⅵ)的还原作用之外,还可能与土壤的还原性增强有关。还原性强的土壤中Cr(Ⅵ)的竞争吸附能力比共存的Fe(Ⅲ)更强,可更多地占据土壤的吸附点位,增加了土壤对Cr(Ⅵ)的吸附[5]。对于35-H组,第20天与第30天5,10,20 cm处取样点土样中的水溶态Cr(Ⅵ)浓度均高于第10天。已有研究发现,微生物的Cr(Ⅵ)还原机制大致可分为3种:1)有氧条件下在可溶性还原酶的催化作用下还原;2)厌氧条件下通过电子传递过程,在微生物可溶性蛋白酶和膜蛋白酶参与下还原,其中碳源或微生物代谢产物作为电子供体被氧化,与此同时,Cr(Ⅵ)作为电子传递链的最终电子受体被还原;3)借助于自身代谢产物进行间接还原[31]。因此,在土壤中水溶态Cr(Ⅵ)浓度相对较低的情况下,初始时外源混合芽孢杆菌可利用土壤中丰富的营养物质以及少量的自身代谢产物作为碳源,通过有氧酶促还原、厌氧电子传递和间接还原作用将Cr(Ⅵ)还原为Cr(Ⅲ),在此过程中自身大量生长繁殖,土壤中氨基酸、维生素和有机酸等细菌代谢产物含量随之增多,还原作用进一步增强,且在此过程中土壤还原性也不断增强,使其对水溶态Cr(Ⅵ)的吸附量增加,因此第10天取样的土样中水溶态Cr(Ⅵ)浓度较低。然而随着土壤中细菌数量的增长,土壤中营养物质消耗速度加快,碳源浓度无法满足细菌生长的需求,加之Cr(Ⅵ)对细菌的损伤作用[32],使混合芽孢杆菌总体浓度呈下降趋势,Cr(Ⅵ)还原能力受限,土壤还原性降低,土壤胶体对Cr(Ⅵ)的吸附量减少,而土壤中Cr(Ⅵ)难溶物的溶解作用、土壤胶体Cr(Ⅵ)的解吸作用、土壤溶液中Cr(Ⅲ)的氧化作用正常进行,由此导致第20天和第30天取样土样中的水溶态Cr(Ⅵ)浓度相比于第10天取样升高。另外,如图4a所示,175-H组土样的水溶态Cr(Ⅵ)浓度在第10天取样时普遍最高且随着时间增加浓度逐渐降低。总体来说,Cr(Ⅵ)的初始浓度越高,菌种生长受到的抑制作用越明显,其还原Cr(Ⅵ)的能力越弱[33]。然而细菌在还原Cr(Ⅵ)的同时,Cr(Ⅵ)对细菌产生一定的毒性,且浓度越高,毒性越大。Cr(Ⅵ)会使部分细菌形态明显改变,出现萎缩变形,甚至溶解坏死。有文献表明,细菌溶解所释放的构酶可以在胞内或者胞外催化Cr(Ⅵ)[34,35],蜡样芽孢杆菌可能具有类似的还原机制,其溶解坏死后释放出Cr(Ⅵ)还原酶,可还原Cr(Ⅵ)[32]。这可能是混合芽孢杆菌存在条件下高浓度Cr(Ⅵ)的土壤中Cr(Ⅵ)浓度下降的原因之一。
2.4 土样中微生物分析
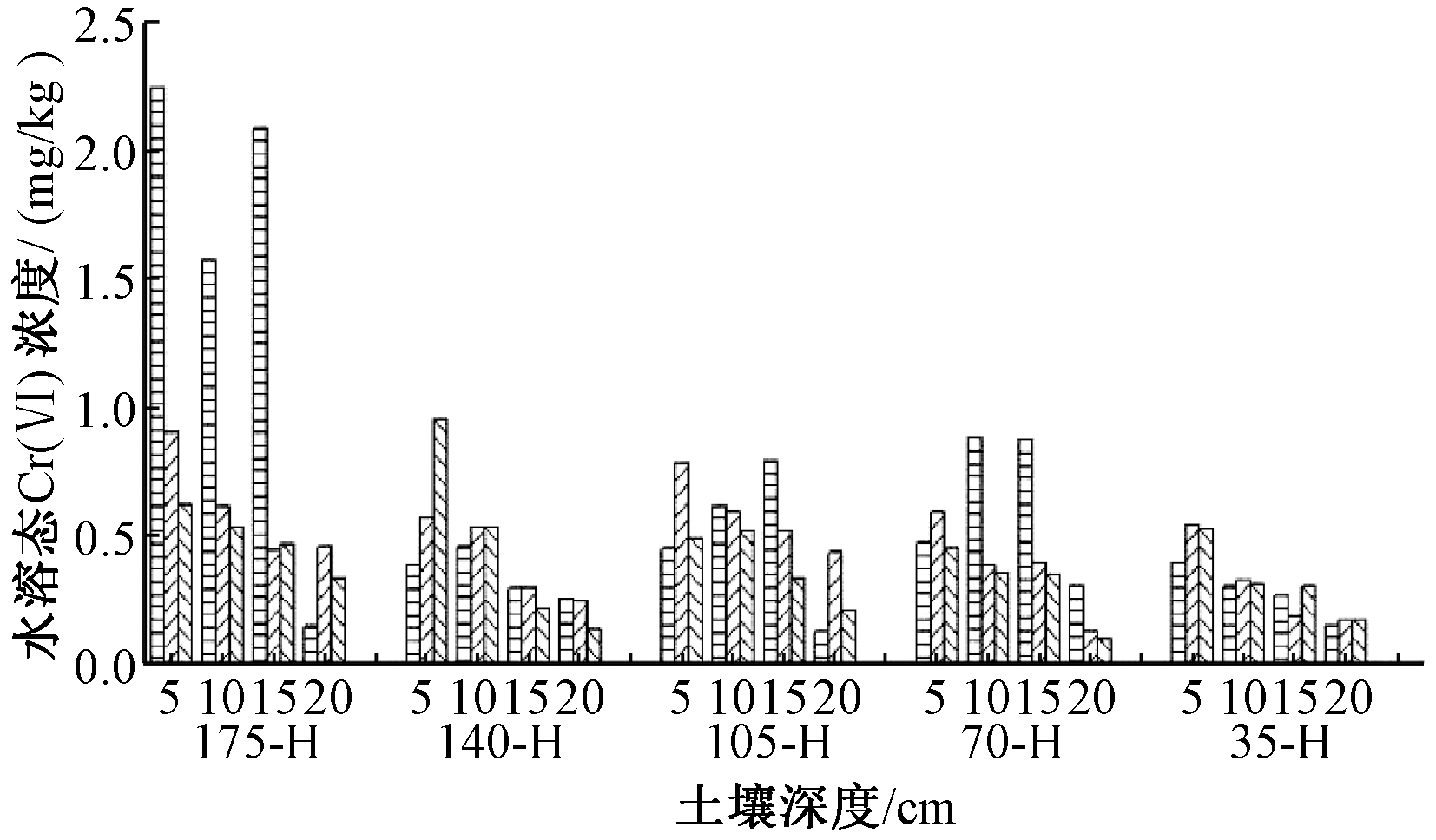
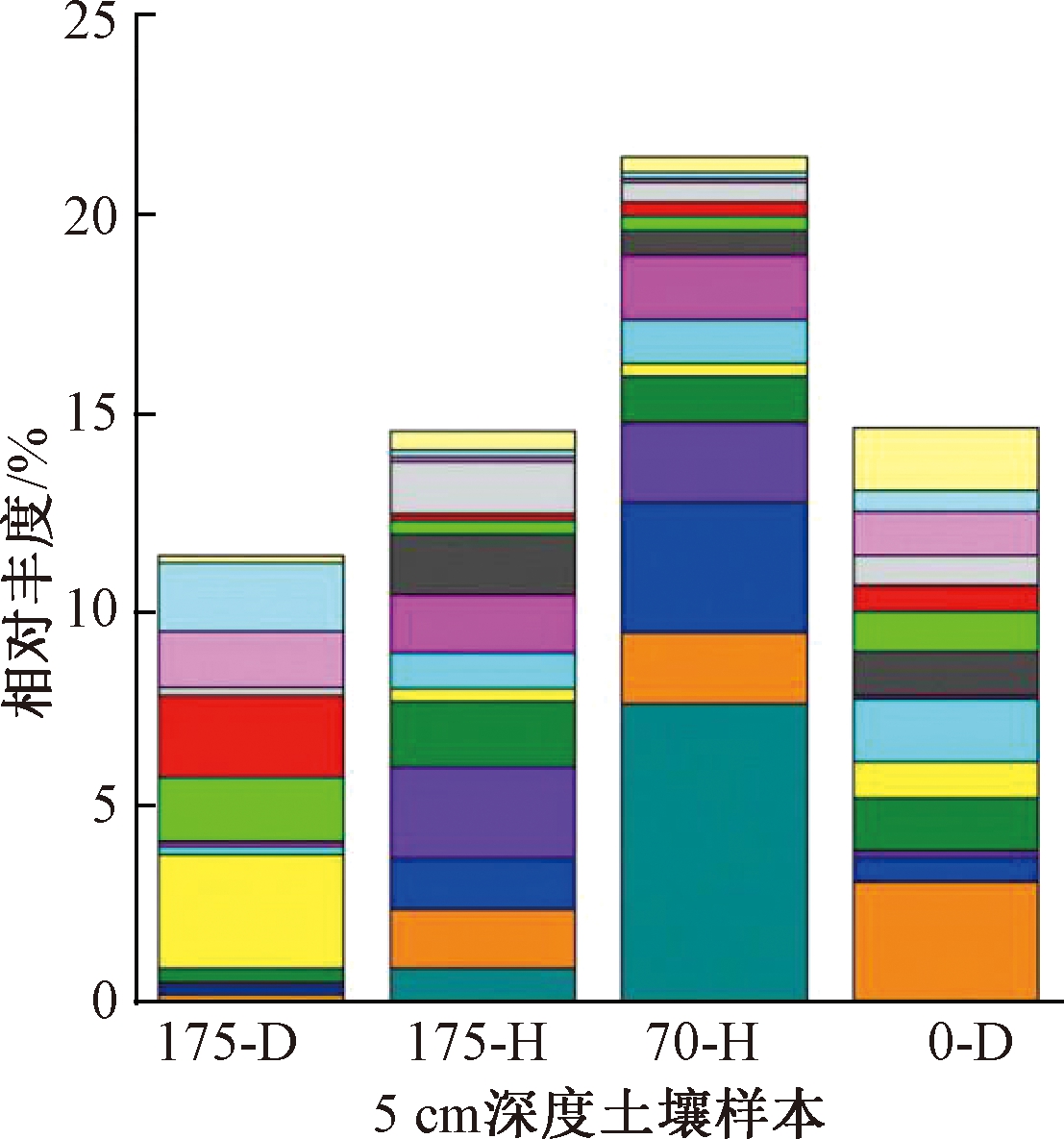
4组样品属水平群落组成见图5。与0-D组5 cm深度的土样相比,175-D组5 cm深度的土样中微生物多样性有所减少。Lysobacter、Phenylobacterium、Variovorax、Rubrivivax等属的菌种相对丰度减小,且Perlucidibaca几乎消失,说明Cr(Ⅵ)抑制了其生长繁殖,其原因可能是高浓度的Cr(Ⅵ)改变了土壤的氧化还原性质,进而影响了微生物所需营养物质的合成及微生物对营养物质的吸收代谢过程;或者Cr(Ⅵ)本身对这些微生物有一定的毒害作用,破坏了其正常的生理结构和功能并导致其死亡。但Candidatus Nitrososphaera、Arthrobacter、Mycobacterium、Norcardioides等属的菌种相对丰度增大,可能由于其对Cr(Ⅵ)具有一定的耐受性和还原能力,通过还原Cr(Ⅵ)产生能量供给自身细胞合成[31],如已有研究中节杆菌Arthrobacter sp.能显著促进土壤中Cr(Ⅵ)的还原[36];Lysobacter等属菌种相对丰度减小使环境营养物质竞争力减小也是Candidatus等属菌种相对丰度增大的可能原因之一。175-D组与0-D组土样相比,芽孢杆菌相对丰度更大,说明芽孢杆菌对高浓度Cr(Ⅵ)具有耐受性、适应性和生长优势。
![]() Rubrivivax;
Rubrivivax; ![]() Nocardioides;
Nocardioides; ![]() Arthrobacter;
Arthrobacter; ![]() HB2-32-21;
HB2-32-21; ![]() Mycobacterium;
Mycobacterium; ![]() Candidatus Nitrososphaer;
Candidatus Nitrososphaer; ![]() Perlucidibaca;
Perlucidibaca; ![]() Bacilius;
Bacilius; ![]() Variovorax;
Variovorax; ![]() Iamia;
Iamia; ![]() Methylibium;
Methylibium; ![]() Flacisolibacter;
Flacisolibacter; ![]() Phenylobacterium;
Phenylobacterium; ![]() Lysobacter;
Lysobacter; ![]() Anaeromyxobacter。
Anaeromyxobacter。
注:上方空白部分是其他属的丰度和不能鉴定到属水平的序列丰度总和。
图5 16S测序样品属水平群落组成
Figure 5 Community composition of 16S rRNA sequencing samples (genus level)
对比175-D组与175-H组5 cm深度土样的微生物群落组成,可得土样中加入混合芽孢杆菌后Candidatus Nitrososphaera、 Arthrobacter、Mycobacterium、Norcardioides等属的菌种相对丰度减小,而Anaeromyxobacter、Lysobacter、Phenylobacterium、Flavisolibacter、Perlucidibaca、Rubrivivax、Variovorax等属的菌种相对丰度增大。因前者可能与混合芽孢杆菌存在相对较大的竞争关系,而后者菌种可能与混合芽孢杆菌互利共生、协同生长。在土柱中加入芽孢杆菌后,175-H组土样中芽孢杆菌的相对丰度明显增大,进一步说明混合芽孢杆菌良好的Cr(Ⅵ)耐受性,并且其对土壤中水溶态Cr(Ⅵ)浓度的降低起到重要作用。
对比175-H组与0-D组5 cm深度土样的微生物群落组成,可发现虽然在土壤中加入混合芽孢杆菌后Cr(Ⅵ)含量有所下降,减轻了对部分微生物的毒害作用,但对照组土样中如Lysobacter、Variovorax和Arthrobacter等微生物相对丰度仍有所减小,而增加了如Anaeromyxobacter等在对照组土样中相对丰度极小的微生物,这可能是混合芽孢杆菌对Cr(Ⅵ)的还原改变了土壤中的亚铁、黏粒和砂粒含量[36],从而影响相关微生物的正常生长代谢活动。
对比175-H组和70-H组5 cm深度土样的微生物群落组成,发现70-H组土样中Anaeromyxobacter和Phenylobacterium大量繁殖,相对丰度大于175-H组土样,可能由于较低浓度的Cr(Ⅵ)生物毒性较小,对这2个属菌种的生长抑制作用较小。175-H组土样以Flavisolibacter、Methylibium属为优势菌种,70-H组土样以Anaeromyxobacter、Phenylobacterium和Flavisolibacter属为优势菌种,而芽孢杆菌属Bacillus在2组土样中的相对丰度都小于上述优势菌种,但目前并无研究证据表明上述优势菌种有显著的Cr(Ⅵ)还原能力,故认为导致土壤中水溶态Cr(Ⅵ)减少的微生物作用仍以芽孢杆菌的还原作用占主导。
3 结 论
1)水溶态Cr(Ⅵ)主要将土壤中水分的迁移作为迁移动力。在自然无干扰条件下,土壤中水溶态Cr(Ⅵ)的迁移随着土壤深度增加而下降。在加入混合芽孢杆菌条件下,混合芽孢杆菌对水溶态Cr(Ⅵ)的迁移过程在前期存在较明显的阻碍作用,在中后期对其迁移的影响较微弱。中后期混合芽孢杆菌组中水溶态Cr(Ⅵ)的迁移变化与自然无干扰条件下类似。
2)原始土样中土壤的自净能力使其能较小程度地降低外来污水中水溶态Cr(Ⅵ)的浓度。在水溶态Cr(Ⅵ)浓度较低时,混合芽孢杆菌土样中混合芽孢杆菌可通过利用碳源将Cr(Ⅵ)还原为Cr(Ⅲ),还原能力较强;在水溶态Cr(Ⅵ)浓度较高时,混合芽孢杆菌的生长代谢活动会受到一定程度的抑制,还原Cr(Ⅵ)能力较弱。
[1] 考庆君,吴坤.铬的生物学作用及毒性研究进展[J].中国公共卫生,2004,20(11):1398-1400.
[2] 陈英旭,何增耀,吴建平.土壤中铬的形态及其转化[J].环境科学,1994,15(3):53-56.
[3] KRISHNA K R, PHILIP L. Bioremediation of Cr(Ⅵ) in contaminated soils[J]. Journal of Hazardous Materials, 2005, 121(1/2/3): 109-117.
[4] 张聪慧,申向东,邹欲晓.土壤中Cr(Ⅵ)离子在低温环境中的迁移规律研究[J].农业环境科学学报,2019,38(9):2138-2145.
[5] 王成文,许模,张俊杰,等.土壤pH和Eh对重金属铬(Ⅵ)纵向迁移及转化的影响[J].环境工程学报,2016,10(10):6035-6041.
[6] 张蕊. Cr(Ⅵ)在土壤中迁移转化影响因素研究及风险评价[D].长春:吉林大学,2013.
[7] 魏蓝. 土壤微生物对六价铬的还原及稳定化效果研究[D].苏州:苏州科技大学,2017.
[8] 苏长青,李立清,杨志辉,等.好氧条件下铬污染土壤中Cr(Ⅵ)的土著微生物还原[J].中国有色金属学报(英文版),2019,29(6):1304-1311.
[9] 肖伟,王磊,张思维,等.Cr(Ⅵ)还原细菌Bacillus cereus S5.4的筛选鉴定及还原特性研究[J].工业微生物,2007,37(6):1-6.
[10] 朱培蕾,焦仕林,姜朴,等.Cr(Ⅵ)还原菌Cr4-1的鉴定和还原影响因素的优化[J].卫生研究,2015,44(2):201-205,210.
[11] 郝孔利,张杰.细菌和真菌去除Cr(Ⅵ)机理的研究进展[J].环境科技,2018,31(6):66-70.
[12] 赵虎彪. 铁系物还原稳定技术在铬污染土壤修复中的应用研究[D].杭州:浙江大学,2019.
[13] GUAN X H, DONG H R, MA J, et al. Simultaneous removal of chromium and arsenate from contaminated groundwater by ferrous sulfate: batch uptake behavior[J].Journal of Environmental Sciences, 2011, 23 (3):372-380.
[14] ACHAL V, KUMARI D, PAN X. Bioremediation of chromium contaminated soil by a brown-rot fungus, Gloeophyllum sepiarium[J].Research Journal of Microbiology, 2011, 6(7):166-171.
[15] DAS S, MISHRA J, DAS S K, et al. Investigation on mechanism of Cr (Ⅵ) reduction and removal by Bacillus amyloliquefaciens, a novel chromate tolerant bacterium isolated from chromite mine soil[J].Chemosphere, 2014, 96 (2):112-121.
[16] BESTAWY E E, HELMY S, HUSSIEN H, et al. Bioremediation of heavy metal-contaminated effluent using optimized activated sludge bacteria[J].Applied Water Science, 2013, 3 (1):181-192.
[17] 孙慧慧. 污泥—豆渣联合修复铬污染土壤研究[D].重庆:重庆大学,2018.
[18] INTHAVONGXAI PHOUNGERN(金山). 厌氧污泥、餐厨垃圾与硫酸亚铁协同处理铬污染土壤实验研究[D].南宁:广西大学,2018.
[19] 中华人民共和国农业部.土壤检测第6部分:土壤有机质的测定:NY/T 1121.6—2006[S].北京:中国农业出版社, 2006.
[20] BURTON E D, CHOPPALA G, KARIMIAN N, et al. A new pathway for hexavalent chromium formation in soil: fire-induced alteration of iron oxides[J]. Environmental Pollution, 2019,247: 618-625.
[21] 中华人民共和国国家标准GB 7467—87水质 三价铬的测定 二苯酰二肼分光光度法[S].北京:国家标准出版社, 2012.
[22] LI X Z, RUI J D, MAO Y J, et al. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar[J]. Soil Biology and Biochemistry, 2014,68: 392-401.
[23] LOZUPONE C A, KNIGHT R. UniFrac: a new phylogenetic method for comparing microbial communities[J]. Applied and Environmental Microbiology, 2005,71: 8228-8235.
![]() T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011,27(21): 2957-2963.
T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011,27(21): 2957-2963.
[25] RUI J P, LI J B, ZHANG S H, et al. The core populations and co-occurrence patterns of prokaryotic communities in household biogas digesters[J]. Biotechnology for Biofuels, 2015,8: 158.
[26] 李晶晶,彭恩泽.综述铬在土壤和植物中的赋存形式及迁移规律[J].工业安全与环保,2005,31(3):31-33.
[27] 容群,罗栋源,边鹏洋,等.土壤中铬的迁移转化研究进展[J].四川环境,2018,37(2):156-160.
[28] 傅臣家,刘洪禄,吴文勇,等.六价铬在土壤中吸持和迁移的试验研究[J].灌溉排水学报,2008,27(2):9-13,42.
[29] 应珊珊. 基于贝叶斯方法的土壤溶质迁移转化反演研究[D].杭州:浙江大学,2018.
[30] 裴青宝. 红壤土壤水分溶质运移特性及滴灌关键技术研究[D].西安:西安理工大学,2018.
[31] 何敏艳. 高效铬还原菌Bacillus cereus SJ1和Lysinibacillus fusiformis ZC1的铬还原特性和全基因组序列分析[D].武汉:华中农业大学,2010.
[32] 焦仕林,朱培蕾,姜朴,等.蜡样芽孢杆菌还原六价铬效果分析[J].中国公共卫生,2016,32(10):1326-1329.
[33] 张玥,岳蕙颖,王进.一株耐铬细菌的除铬研究[J].广东化工,2015,42(24):80-81.
[34] PRIESTER J H,OLSON S G,WEBB S M, et al. Enhanced exopolymer production and chromium stabilization in Pseudomonas putida unsaturated biofilms[J]. Applied and Environmental Microbiology,2006,72(3):1988-1996.
[35] DOGAN N M,KANTAR C,GULCAN S, et al. Chromium(Ⅵ) bioremoval by Pseudomonas bacteria: role of microbial exudates for natural attenuation and biotreatment of Cr(Ⅵ) contamination[J]. Environmental Science & Technology,2011,45(6):2278-2285.
[36] 肖文丹,叶雪珠,孙彩霞,等.铬耐性菌对土壤中六价铬的还原作用[J].中国环境科学,2017,37(3):1120-1129.