0 引 言
随着制革、电镀、印染及铬盐生产等产业的迅速发展,铬污染物排放量迅猛增长,铬污染土壤问题尤为严重,已经成为人们普遍关注的环境问题之一,Cr(Ⅵ)已被美国超级基金列为优先控制的前20种有毒物质之一。Cr(Ⅵ)化合物的毒性很强,世界卫生组织下属的国际癌症研究署(IARC)已将Cr(Ⅵ)划分在第一组致癌物质中[1]。因此,对土壤中Cr(Ⅵ)污染的治理迫在眉睫。
铬污染渣土中Cr(Ⅵ)的存在形式主要有四水铬酸钠、铬酸钙铬、化学吸附的![]() 铝酸钙、碱式铬酸铁、硅酸钙-铬酸钙固溶体、铁铝酸钙-铝酸钙固溶体。Cr(Ⅵ)的前5种形式在水中易溶、稍溶或微溶,习惯上称为水溶Cr(Ⅵ);后2种形式则以固溶体形式存在于硅酸二钙、铁铝酸钙晶格内,难溶于水,也难以在较短时间内同还原剂或沉淀剂完全反应,需要强酸条件破坏晶格后才能溶出,习惯称为酸溶Cr(Ⅵ)[2]。
铝酸钙、碱式铬酸铁、硅酸钙-铬酸钙固溶体、铁铝酸钙-铝酸钙固溶体。Cr(Ⅵ)的前5种形式在水中易溶、稍溶或微溶,习惯上称为水溶Cr(Ⅵ);后2种形式则以固溶体形式存在于硅酸二钙、铁铝酸钙晶格内,难溶于水,也难以在较短时间内同还原剂或沉淀剂完全反应,需要强酸条件破坏晶格后才能溶出,习惯称为酸溶Cr(Ⅵ)[2]。
纪柱[3]分析了我国早期湿法解毒渣返黄的原因,认为我国早期铬渣湿法解毒不加或只加很少量酸,渣中酸溶态Cr(Ⅵ)未全部溶出,还原剂无法将固溶体内酸溶Cr(Ⅵ)还原,残留的固溶体在水和CO2长时间作用下逐渐水化,CaCrO4释放出并溶于水(无水CaCrO4在室温下水中溶解度约为2%),CaCrO4溶液在毛细管作用下,上升至渣土表面,析出黄色晶体CaCrO4,致土壤表面“返黄”。
Dermatas等[4]长达240 d的研究表明:加入理论添加量5倍和8倍的FeSO4·7H2O处理Cr(Ⅵ),反应初期Cr(Ⅵ)含量降低较快,但随着时间延长,Cr(Ⅵ)含量再次上升,在5倍FeSO4·7H2O添加量下,反应240 d Cr(Ⅵ)含量最低仍达到588 mg/kg;加入理论添加量8倍的FeSO4·7H2O后,Cr(Ⅵ)的TCLP浸出浓度最初低于5 mg/L,但420 d的长期监测结果发现,Cr(Ⅵ)浸出浓度出现反弹。
传统铬污染土壤修复技术以FeSO4·7H2O为主要修复药剂。FeSO4·7H2O价格低廉,实施方便,但最大的不足是在自然环境中容易发生氧化,失去还原效能。当污染土壤以水溶态为主时,直接投加还原剂作用迅速有效,但酸溶态占比高时,则难以与还原剂接触发生还原反应,而这部分Cr(Ⅵ)释放时,需要加入额外的超量还原剂。但FeSO4·7H2O在自然环境中容易发生氧化,且容易被水冲洗流失,失去还原效能,无法完全还原缓慢释放的酸溶态Cr(Ⅵ),处理后的土壤仍然存在较大的环境风险隐患[5-8]。因此需对铬污染土壤的处理效果及长期稳定性进行深入细致的研究,开发铬污染土壤的绿色长效还原稳定化药剂,对缓慢释放出的酸溶态Cr(Ⅵ)进行有效处理。
硫铁矿原料来源广、成本低廉,在pH和ORP(氧化还原电位)不断变化的自然条件下能够保持长期稳定性,是对土壤Cr(Ⅵ)修复具有较大潜力的长效缓释还原剂。目前已有较多利用硫铁矿处理废水中Cr(Ⅵ)的研究,发现硫铁矿可以在较短时间内达到较高的Cr(Ⅵ)去除率[9-13],如水体中Cr(Ⅵ)初始浓度为10 mg/L,在反应时间为30 min的条件下,当黄铁矿投加量增加到28 g/L时,对Cr(Ⅵ)去除率高达98.18%[13]。但是目前利用硫铁矿处理铬污染土壤的研究较少,因此本文主要考察硫铁矿对酸溶态占比高的铬污染土壤的长效还原稳定效果,以期为解决Cr(Ⅵ)土壤修复难题奠定良好基础。
单一FeSO4·7H2O还原剂处理铬污染土壤反应速度快,但对酸溶态Cr(Ⅵ)还原不彻底,且残余还原剂易失效,对污染土壤中持续溶出的酸溶态Cr(Ⅵ)处理效果有限,无法确保污染土壤修复效果的长期稳定性[5]。而硫铁矿具有不易被水冲洗流失,能在土壤环境中长期存在,不被轻易氧化损失的特点[14],但是反应时间长。因此,本文在试验设计采用分步还原,先加入FeSO4·7H2O快速还原,再加入硫铁矿作为长效缓释还原剂进一步稳定修复效果,探究反应时间和还原剂用量对处理效果的影响,以期为Cr(Ⅵ)污染土壤的治理提供新思路。
1 试验部分
1.1 试验土样及硫铁矿
试验土样T1和T2来自不同污染场地,将土样风干后过孔径为2 mm的标准筛后装袋备用。T1土样中Cr(Ⅵ)含量为2256.11 mg/kg,采用GB 5086.1—1997《固体废物 浸出毒性浸出方法 翻转法》测得的Cr(Ⅵ)浸出浓度为65.21 mg/L,水溶态占比为28.9%,T1土样中酸溶态Cr(Ⅵ)占比较高。T2土样的Cr(Ⅵ)含量为1402.67 mg/kg,测得Cr(Ⅵ)浸出浓度为115.33 mg/L,水溶态占比为82.2%,T2土样以水溶态Cr(Ⅵ)为主。
硫铁矿为从某矿山挑选的黄铁矿纯矿物经磨细制成,含硫量为48.06%,含铁量为42.25%,粒度为92%过200目筛。
1.2 试验方法
1.2.1 FeSO4·7H2O还原稳定化处理不同类型土壤
T1土样酸溶态Cr(Ⅵ)占比较高,T2土样以水溶态Cr(Ⅵ)为主,选用FeSO4·7H2O作为快速还原稳定化药剂,考察了FeSO4·7H2O处理不同类型土壤的修复效果。将T1和T2的风干土样分别称取6份于密封袋中,每份重量为1 kg,土样中分别加入不同质量的FeSO4·7H2O,将药剂与土样搅拌均匀,分别加入200 mL水,养护3 d后采用GB 5086.1—1997检测土壤中Cr(Ⅵ)浓度。
1.2.2 硫铁矿还原稳定化处理铬污染土壤
选用T2土样进行试验,称取4份相同的1 kg风干土样放置于密封袋中,向土中分别加入不同量的硫铁矿,m(硫铁矿)∶m(土)分别为1%、2%、5%、10%、15%和20%,将硫铁矿与土样混合均匀,再分别加入200 mL水,养护3,5,7,11,14 d后取样,利用翻转法浸出固体废物毒性,采用去离子水作为浸取剂,测定硫铁矿处理后土壤中Cr(Ⅵ)浸出浓度。
1.2.3 FeSO4·7H2O-硫铁矿分步还原处理铬污染土壤
选用T1土样进行试验,称取4 kg风干土样放置于密封袋中,采用分步还原法,先加入与土样质量比为2%的FeSO4·7H2O,与土样混合均匀,800 mL水,加入养护3 d后,测量Cr(Ⅵ)浸出浓度。再将土样平均分成4份,每份1 kg,向其中3份分别加入与土样质量比为1%、3%和5%的硫铁矿,另一份不加硫铁矿继续养护,反应至7,17,30,88,281,396,540 d后采用GB 5086.1—1997检测土壤中Cr(Ⅵ)的浸出浓度。
1.3 检测分析方法
为避免由于土壤的不均一性对效果检测的影响,每次检测采集3份平行土样进行分析。按照GB 5086.1—1997制备浸出液,以去离子水作为浸取剂,固液比为1∶10。按照GB/T 15555.4—1995《固体废物 Cr(Ⅵ)的测定 二苯碳酰二肼分光光度法》测定六价铬浓度,检测时按标准中规定步骤排除还原性物质干扰。
2 结果与讨论
2.1 FeSO4·7H2O还原稳定化处理不同类型土壤的效果
表1、表2分别为FeSO4·7H2O处理T1、T2土样,养护3 d后的修复效果。
表1 FeSO4·7H2O添加量对T1土样Cr(Ⅵ)浸出浓度的影响
Table 1 Effect of FeSO4·7H2O addition on Cr(Ⅵ) leaching concentration of T1 soil sample
FeSO4·7H2O添加量/%13691215Cr(Ⅵ)浸出浓度/(mg/L)54.2815.241.130.750.680.58
表2 FeSO4·7H2O添加量对T2土样Cr(Ⅵ)浸出浓度的影响
Table 2 Effect of FeSO4·7H2O addition on Cr(Ⅵ) leaching concentration of T2 soil sample
FeSO4·7H2O添加量/%23581012Cr(Ⅵ)浸出浓度/(mg/L)15.110.1010.0560.0390.0310.025
由表1、表2可知:T2土样在FeSO4·7H2O添加量为3%(约为理论添加量的1.25倍)时,Cr(Ⅵ)浸出浓度即可达到GB 8978—1996《污水综合排放标准》一级标准(0.5 mg/L),而T1土样在FeSO4·7H2O为15%(约为理论添加量的4.16倍)时,仍未达到修复目标。
T2土样以水溶态Cr(Ⅵ)为主,相对于T1土样更容易修复达标。当水溶态Cr(Ⅵ)占比较大时,还原稳定化处理后,较短的处理时间即能确保Cr(Ⅵ)浸出浓度达到相应标准,且还原相对较为彻底。T1土样酸溶态Cr(Ⅵ)占比高,自然养护条件下酸溶态Cr(Ⅵ)释放缓慢,难以发生还原反应;未反应完全的酸溶态Cr(Ⅵ)在翻转振荡中,存在大量Cr(Ⅵ)释放,试验测得浸出液pH为7.5~9.6,此时浸出液中同时存在过量的FeSO4·7H2O还原剂和Cr(Ⅵ),虽然碱性条件下,Fe(Ⅱ)也能还原Cr(Ⅵ),但反应速度慢。根据杨广平等[15]的研究发现,pH>5时,FeSO4·7H2O完全还原Cr(Ⅵ)所需的时间大于50 min;过量的FeSO4·7H2O处理T1土样,Cr(Ⅵ)去除效果仍不理想,可能是翻转振荡过程加速了酸溶态Cr(Ⅵ)的释放[16],而体系pH过高,还原反应速度慢,过量的FeSO4·7H2O未能及时还原Cr(Ⅵ)的原因。
因此,酸溶态Cr(Ⅵ)占比高的土样,Cr(Ⅵ)难溶出,应确保后期有足够的还原药剂与之发生还原反应,且应保证Cr(Ⅵ)的释放速度与还原反应速度相匹配,确保土壤淋溶液中Cr(Ⅵ)的浸出浓度满足相关标准要求,使土壤达到长期稳定状态。
2.2 硫铁矿还原稳定化处理铬污染土壤的效果
2.2.1 硫铁矿用量对Cr(Ⅵ)浸出浓度的影响
图1为不同反应时间下Cr(Ⅵ)的浸出浓度随着硫铁矿投加量的变化。可知:随着硫铁矿添加量的增加,Cr(Ⅵ)浸出浓度不断降低。鲁安怀[17,18]的研究表明:硫铁矿在一定条件下有微溶作用,可以释放出Fe2+、S2-、S22-等离子,通过氧化还原作用(S/S2-与Cr6+/Cr3+电对、S/S22-与Cr6+/Cr3+电对、Fe3+/Fe2+与Cr6+/Cr3+电对)和沉淀转化作用(S2-和Cr3+)实现土壤中Cr(Ⅵ)的去除,并生成Cr2S3难溶物。
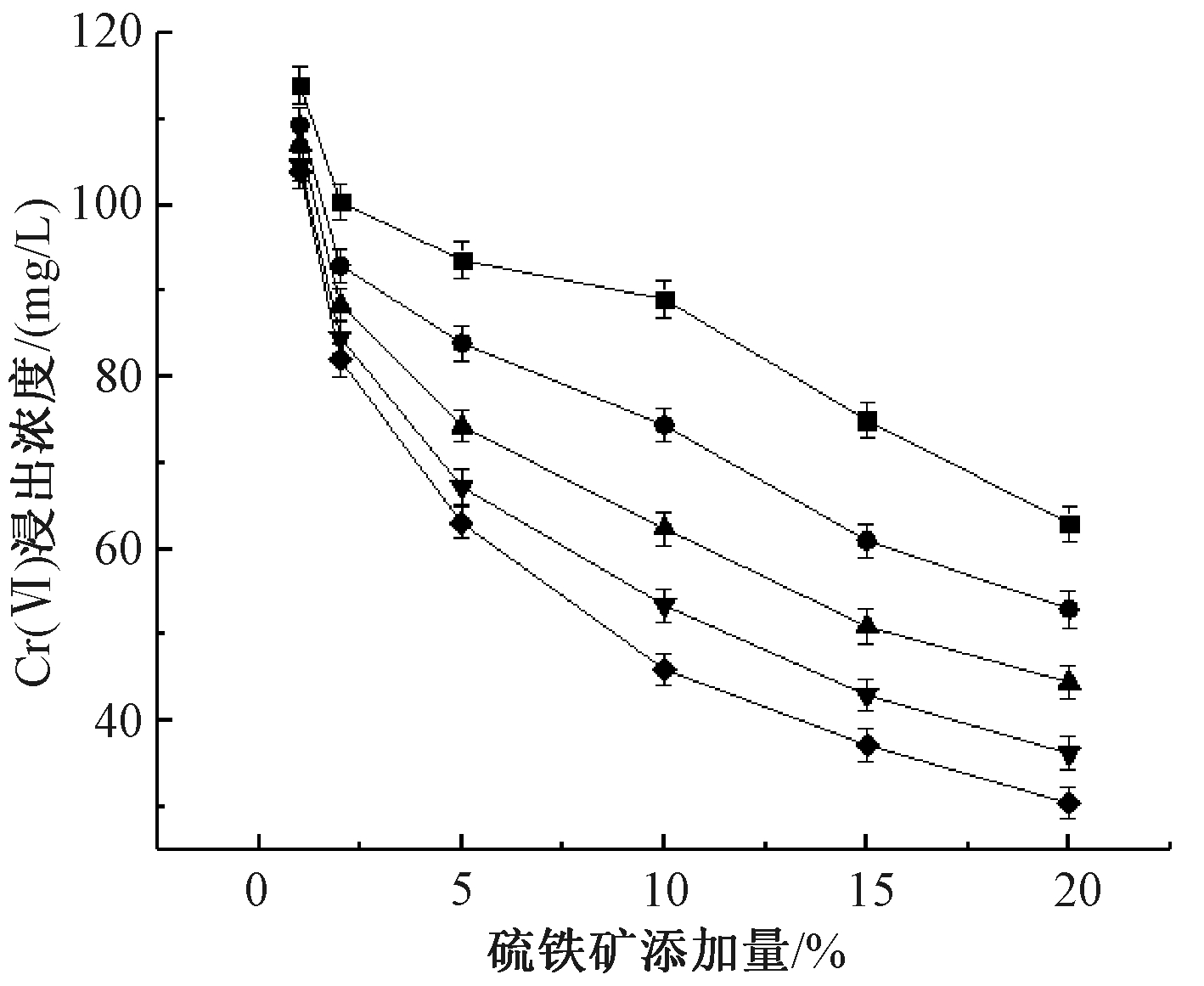
反应时间/d:![]() —3;
—3; ![]() —5;
—5; ![]() —7;
—7; ![]() —11;
—11; ![]() —14。
—14。
图1 硫铁矿添加量对土壤中Cr(Ⅵ)浸出浓度和去除率的影响
Figure 1 Effects of pyritic dosages on the leaching concentration and removal rate of Cr(Ⅵ) in soils
当硫铁矿添加量为20%,反应14 d时,土壤中Cr(Ⅵ)浸出浓度降至30.4 mg/L。根据GB 8978—1996,Cr(Ⅵ)浸出浓度应<0.5 mg/L,在添加20%的硫铁矿,反应14 d时,浸出浓度仍远超出目标值,但尚有明显的下降趋势。浸出浓度高,一方面是因为土壤中仍有部分的酸溶态Cr(Ⅵ)未溶出,另一方面硫铁矿属于微溶金属矿物,还原性离子的释放速度慢,在该反应时间内未与Cr(Ⅵ)反应完全,尚未达到其饱和去除率。
随着硫铁矿添加量的增加,活性位点数量随之增加,促进了硫铁矿对Cr(Ⅵ)的去除[19]。在反应发生的初始阶段,硫铁矿表面可供Cr(Ⅵ)占据的活性位点数量与投加的硫铁矿量之间呈正相关,活性位点的数量随着硫铁矿投加量的增加而增加[20],此时Cr(Ⅵ)浸出浓度也随之显著降低。
2.2.2 反应时间对Cr(Ⅵ)浸出浓度的影响
加入不同量的硫铁矿后,土壤中Cr(Ⅵ)的浸出浓度随时间的变化如图2所示。可知:随着反应时间的延长,Cr(Ⅵ)的浸出浓度逐渐下降。加入不同添加量的硫铁矿后,Cr(Ⅵ)的浸出浓度不断降低,表明硫铁矿可以持续还原溶出的Cr(Ⅵ),但反应速率逐渐减慢。

硫铁矿/%:![]() —1;
—1; ![]() —2;
—2; ![]() —5;
—5; ![]() —10;
—10; ![]() —15;
—15; ![]() —20。
—20。
图2 不同反应时间对Cr(Ⅵ)浸出浓度的影响
Figure 2 Effects of different experimental duration on the leaching concentration of Cr(Ⅵ)
从物理反应角度分析,反应初期硫铁矿表面的活性位点充足,且Cr(Ⅵ)在污染土壤和硫铁矿中存在的浓度差较大,浓度差会产生传质驱动力[21],有利于反应的进行。随着反应的不断进行,硫铁矿表面的活性位点逐渐被Cr(Ⅵ)占据,且污染土壤与硫铁矿之间的Cr(Ⅵ)浓度差减小,Cr(Ⅵ)在硫铁矿中的扩散作用减弱,硫铁矿对Cr(Ⅵ)的去除率会逐渐减弱。
从化学反应角度分析,反应速率还与硫铁矿和氧化剂之间的电子传递速率有关。![]() 的标准电极电位为
的标准电极电位为![]() 的标准电极电位为-0.12 V,Fe2+/Fe3+的标准电极电位为0.771 V。重金属的标准氧化还原电势与Fe2+、S2-以及S的标准氧化还原电势相差越大,硫铁矿对重金属的还原反应越彻底[22]。Fe2+、S2-和
的标准电极电位为-0.12 V,Fe2+/Fe3+的标准电极电位为0.771 V。重金属的标准氧化还原电势与Fe2+、S2-以及S的标准氧化还原电势相差越大,硫铁矿对重金属的还原反应越彻底[22]。Fe2+、S2-和![]() 作为中间介质参与硫铁矿与Cr(Ⅵ)之间的氧化还原反应,随着反应时间增加,矿物表面的Fe2+、S2-和
作为中间介质参与硫铁矿与Cr(Ⅵ)之间的氧化还原反应,随着反应时间增加,矿物表面的Fe2+、S2-和![]() 溶解速率减慢[23],硫铁矿与Cr(Ⅵ)之间的电子传递速率相应减慢。
溶解速率减慢[23],硫铁矿与Cr(Ⅵ)之间的电子传递速率相应减慢。
从硫铁矿用量和反应时间对硫铁矿浸出浓度的影响可以看出:直接用硫铁矿处理土壤中Cr(Ⅵ),存在药剂添加量大、还原慢、短期内难以达到修复目标等问题,因此有必要采取快速还原和长效处理相结合的方法,针对不同形态的Cr(Ⅵ)进行分步还原,以达到既能缩短达标反应时间、降低药剂成本,同时又能提高Cr(Ⅵ)处理效果的目的。
2.3 FeSO4·7H2O-硫铁矿分步还原处理铬污染土壤的效果研究
根据2.2节的分析,硫铁矿处理Cr(Ⅵ)的反应时间较长,且土壤中Cr(Ⅵ)含量高时即使添加过量的硫铁矿短期内也难以使Cr(Ⅵ)浸出浓度达标。而FeSO4·7H2O属于水溶性还原剂,可在短时间内还原溶出Cr(Ⅵ),且成本低廉。因此,对Cr(Ⅵ)污染土壤采用分步还原法,先加入FeSO4·7H2O迅速去除水溶态Cr(Ⅵ),再加入硫铁矿对后续溶出的酸溶态Cr(Ⅵ)进行持续还原。
先加入与土样质量比为2%的FeSO4·7H2O,反应3 d后再分别加入1%、3%和5%的硫铁矿继续还原。图3显示了加入硫铁矿后Cr(Ⅵ)浸出浓度随反应时间的变化。可知:随着反应时间延长,仅添加FeSO4·7H2O的土样浸出浓度基本保持稳定,加入硫铁矿后,Cr(Ⅵ)浸出浓度显著降低。加入3%的硫铁矿反应27 d,Cr(Ⅵ)浸出浓度降至0.29 mg/L,由于硫铁矿不断还原Cr(Ⅵ),反应体系可达到相对平衡,Cr(Ⅵ)浸出浓度基本稳定。加入5%的硫铁矿,反应4 d后Cr(Ⅵ)浸出浓度降至0.43 mg/L。从长期监测数据看,加入5%的硫铁矿反应速度较快,反应27 d后,3%和5%的添加量下Cr(Ⅵ)浸出浓度无明显差异。根据540 d的长期监测数据,硫铁矿可以有效持续还原土壤中溶出的Cr(Ⅵ),使污染土壤的修复效果得到长期稳定,避免“返黄”现象的发生。
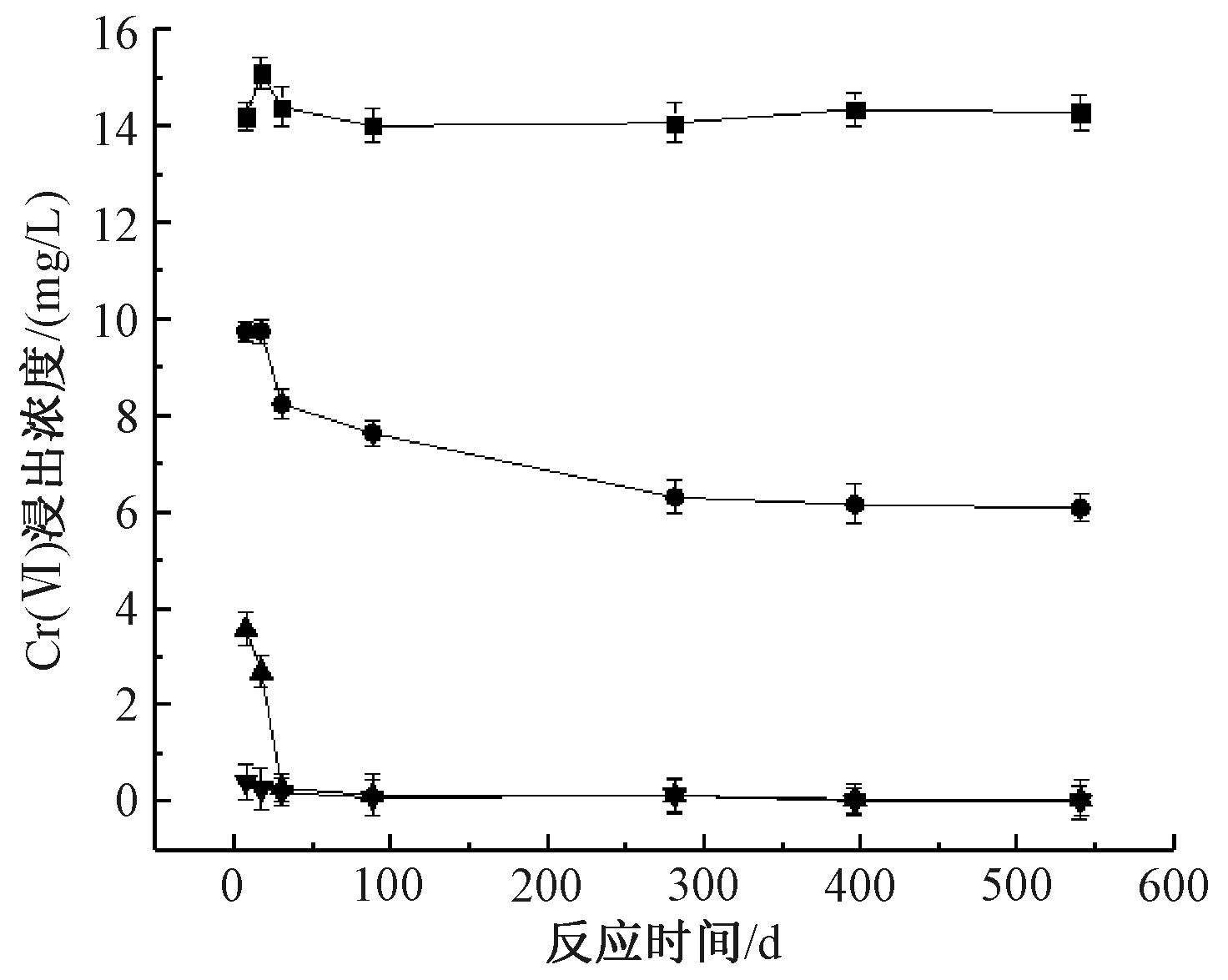
![]() —2% FeSO4·7H2O;
—2% FeSO4·7H2O; ![]() —2% FeSO4·7H2O+1%硫铁矿;
—2% FeSO4·7H2O+1%硫铁矿; ![]() —2% FeSO4·7H2O+3%硫铁矿;
—2% FeSO4·7H2O+3%硫铁矿; ![]() —2% FeSO4·7H2O+5%硫铁矿。
—2% FeSO4·7H2O+5%硫铁矿。
图3 FeSO4·7H2O-硫铁矿分步还原对土壤中Cr(Ⅵ)的影响
Figure 3 Effect of ferrous sulphate-pyrite step reduction on Cr(Ⅵ) in soils
藏磊[11]研究表明:硫精矿处理Cr(Ⅵ)的过程中存在氧化还原、沉淀转化等多种作用。在氧化还原反应阶段,除了Fe2+起到还原作用外,溶液中的S和S2-也具有较强的还原作用。反应时硫铁矿表面的Fe2+溶出,将高价态Cr(Ⅵ)还原为低价态Cr(Ⅲ),同时硫化物氧化为单质S,单质S逐渐形成胶体态S,继而胶体态S吸附S2-形成多硫化物![]() 和S在反应过程中被氧化为
和S在反应过程中被氧化为![]() 促进Fe2+的继续溶解,对反应有显著的催化加速作用。沉淀转化阶段,
促进Fe2+的继续溶解,对反应有显著的催化加速作用。沉淀转化阶段,![]() 与重金属离子生成硫化物沉淀,与Cr3+反应形成Cr2S3、CrS、Cr3S4[9]。
与重金属离子生成硫化物沉淀,与Cr3+反应形成Cr2S3、CrS、Cr3S4[9]。
除了化学氧化还原外,硫铁矿对Cr(Ⅵ)还存在吸附作用,硫铁矿对Cr(Ⅵ)的吸附作用主要包括物理吸附和化学吸附。硫铁矿表面具有一定的活性位点,Cr(Ⅵ)容易进入硫铁矿晶格中占据空缺的位置或替代晶格中的S。史亚丹[24]的研究表明,磁黄铁矿Fe1-xS由于Fe原子亏损存在结构空位,其反应活性强于陨硫铁FeS,对重金属的吸附效果也更好。化学吸附主要发生在吸附共沉淀阶段,由于反应过程中一部分Fe2+被氧化为Fe3+,与水和溶解氧反应形成FeOOH和Fe(OH)3,FeOOH会与重金属发生强烈的络合作用[25],Fe(OH)3和铬的氢氧化物沉淀相当于絮凝剂,可以对铬起到一定的吸附作用,从而加速沉淀,促进Cr(Ⅵ)的去除[26,27]。此外,硫化物颗粒可以为相对微小的Fe(OH)3和铬的氢氧化物颗粒提供活性黏附体,增加与铬的有效碰撞频率,加速絮凝过程,进一步提高对Cr(Ⅵ)的去除效率。
3 结 论
1)采用FeSO4·7H2O处理以水溶态Cr(Ⅵ)为主的T2土样,处理时间短,且还原相对彻底。而对于酸溶态Cr(Ⅵ)占比高的T1土样,即使过量投入,也无法完全还原缓慢释放的酸溶态Cr(Ⅵ),难以修复达标。
2)硫铁矿单独修复铬污染土壤的效果显著,随着硫铁矿添加量的增加以及反应时间的延长,Cr(Ⅵ)浸出浓度显著降低,在添加20%的硫铁矿,反应14 d的条件下,土壤中Cr(Ⅵ)浸出浓度降至30.4 mg/L,仍未达到GB 8978—1996规定的浓度(0.5 mg/L),但尚有下降趋势。
3)采用FeSO4·7H2O和硫铁矿分步还原Cr(Ⅵ),先加入2%的FeSO4·7H2O,养护3 d后再加入3%的硫铁矿反应27 d,Cr(Ⅵ)浸出浓度可降至0.29 mg/L;加入5%的硫铁矿,反应4 d后Cr(Ⅵ)浸出浓度即可降至0.43 mg/L,之后Cr(Ⅵ)浸出浓度保持稳定。根据540 d的长期监测数据,硫铁矿可有效持续还原土壤中溶出的Cr(Ⅵ),使土壤修复效果保持长期稳定。
[1] IARC. IARC monographs on the evaluation of carcino-genic risks to humans volume 49 chrome, nickel and welding[R]. Geneva: World Health Organization, 1997: 17-33.
[2] 王兴润, 李丽, 刘雪,等. 铬渣治理技术的应用进展及特点分析[J]. 中国给水排水, 2009, 25(4): 10-14.
[3] 纪柱. 铬渣长期堆存后的组成变化及对治理的影响[J]. 无机盐工业, 2006,38(9): 8-12.
[4] DERMATAS D, CHRYSOCHOOU M, MOON D H, et al. Ettringite induced heave in chromite ore processing residue (COPR) upon ferrous sulfate treatment[J]. Environmental Science & Technology, 2006, 40(18): 5786-5792.
[5] MOON D H, WAZNE M, DERMATAS D, et al. Long-term treatment issues with chromite ore processing residue (COPR): Cr6+ reduction and heave[J].Journal of Hazardous Materials, 2007, 143(3): 629-635.
[6] JAGUPILLA S C, MOON D H, WAZNE M, et al. Effects of particle size and acid addition on the remediation of chromite ore processing residue using ferrous sulfate [J]. Journal of Hazardous Materials, 2009, 168(1): 121-128.
[7] WANG X, ZHANG J D, WANG L L, et al. Long-term stability of FeSO4·7H2O and H2SO4 treated chromite ore processing residue (COPR): importance of H+ and ![]() [J]. Journal of Hazardous Materials, 2017, 321(5): 720-727.
[J]. Journal of Hazardous Materials, 2017, 321(5): 720-727.
[8] 许友泽. 铬渣堆场污染土壤微生物修复工艺研究[D].长沙:中南大学,2009.
[9] 沈瑜潇. 有机酸协同黄铁矿对Cr(Ⅵ)的还原作用研究[D].南京:南京农业大学,2010.
[10] 崔晋艳, 钱天伟, 丁庆伟, 等. 纳米级天然黄铁矿去除水中Cr6+,Cd2+和Pb2+[J].环境工程学报,2016,10(12):7103-7108.
[11] 臧磊. 硫精矿处理电镀重金属废水的研究[D].西安:西安建筑科技大学,2008.
[12] 王倩. 铁矿石-微生物协同去除水中Cr(Ⅵ)的研究[D].杭州:浙江大学,2010.
[13] 傅贤书. 硫化铁处理含铬废水的进一步研究[J]. 西安冶金建筑学院学报, 1988, 20(1): 1-9.
[14] 陈永亨, 张平, 梁敏华,等. 黄铁矿对重金属的环境净化属性探讨[J]. 广州大学学报(自然科学版), 2007, 6(4): 23-25.
[15] 杨广平, 张胜林, 张林生,等. 含铬废水还原处理的条件及效果研究[J]. 电镀与环保, 2005, 25(2): 38-40.
[16] 李喜林, 王来贵, 赵奎,等. 铬渣浸溶Cr(Ⅵ)溶解释放规律研究:以锦州堆场铬渣为例[J]. 地球与环境, 2013, 41(5): 518-523.
[17] 鲁安怀. 天然铁的硫化物净化含铬污水的新方法[J]. 地学前缘, 1998, 5(2): 242.
[18] 鲁安怀. 矿物法—环境污染治理的第四类方法[J]. 地学前缘, 2005, 12(1): 196-205.
[19] BOSTICK B C, FENDORF S. Arsenite sorption on troilite (FeS) and pyrite (FeS2)[J].Geochimica et Cosmochimica Acta, 2003, 67(5): 909-921.
[20] LU P, CHEN T, LIU H, et al. Green preparation of nanoporous pyrrhotite by thermal treatment of pyrite as an effective Hg(Ⅱ) adsorbent: performance and mechanism[J]. Minerals, 2019, 9(2):74.
[21] 王延明. 铁的硫化矿物对砷的吸附机理研究[D].合肥:合肥工业大学,2012.
[22] MACHIDA M, YAMAZAKI R. Role of minerals in carbonaceous adsorbents for removal of Pb(Ⅱ) ions from aqueous solutions [J]. Separation and Purifcation Technology, 2005, 46(1/2):88-94.
[23] ERDEM M, OZVERDI A. Kinetics and thermodynamics of Cd(Ⅱ) adsorption onto pyrite and synthetic iron sulphide [J]. Separation and Purification Technology, 2006, 51 (3): 240-246.
[24] 史亚丹. 煅烧黄铁矿结构演化及其净化水中砷的作用和机理[D].合肥:合肥工业大学,2015.
[25] DUAN Y H, HAN D S, BATCHELOR B, et al. Synthesis, characterization, and application of pyrite for removal of mercury [J]. Colloids and Surfaces A: Physicochemical Engineering Aspects, 2016, 490: 326-335.
[26] SPRYNSKYY M, BUSZEWSKI B, TERZYK A P, et al. Study of the selection mechanism of heavy metal (Pb2+, Cu2+, Ni2+, and Cd2+) adsorption on clinoptilolite [J]. Journal of Colloid and Interface Science, 2006, 304 (1): 21-28.
[27] CHANDRA A P, GERSON A R. The mechanisms of pyrite oxidation and leaching: a fundamental perspective[J]. Surface Science Reports, 2010, 65(9): 293-315.