铬渣是利用石灰法从铬铁矿中提取Cr(Ⅵ)后的固体残渣,是一种含有大量残余铬的危险工业废弃物[1]。铬渣具有强碱性,内部含有未反应的铬铁矿和未提取的铬酸盐。根据以往生产技术,每生产1 t铬盐可产生3~5 t铬渣,每生产1 t金属铬将排放7 t铬渣[2]。研究表明,铬渣中含5%~7%的总铬,其中2%~5%为Cr(Ⅵ)[3,4]。我国铬盐生产量及消费量均居世界第一,分布于20多个省市,2013年5月环境保护部公布的《2012中国环境状况公报》显示,全国历史遗留铬渣约为670万吨,多数堆存达一二十年,甚至50多年。自2005年《铬渣污染综合整治方案》颁布实施以来,大部分铬渣已得到清理和处置,但仍有一部分仍被堆积[5]。铬渣的堆放和填埋大多未达到危险废物处置的规定标准,部分甚至堆存于重要水源地和人口稠密地区,其长期堆放一方面会造成Cr(Ⅵ)随着雨水冲淋、渗透进入周围土壤和地下水中,对人体健康和生态环境造成严重威胁;另一方面铬渣体积的膨胀难以控制,会对周围建筑物、构筑物造成危害。铬渣目前已成为许多地区主要的岩土和环境地质灾害源[6]。因此,铬渣治理十分必要。
铬在环境中以Cr(Ⅲ)和Cr(Ⅵ)的稳定氧化态存在,Cr(Ⅵ)迁移性大,毒性强,对人体具有高致癌性[1]。而Cr(Ⅲ)毒性低,在环境系统中不易迁移。因此,目前基于Cr(Ⅵ)还原是最常见的处理铬渣的方法,包括化学还原、固化稳定化和微生物还原等。其中,化学还原法的应用范围最广、经济效益最高。有研究采用硫化钠还原法处理铬渣,还原后铬渣中的Cr(Ⅵ)含量为2~5 mg/kg,但解毒后铬渣的稳定性差,一段时间后Cr(Ⅵ)含量增至21~28 mg/kg[7]。在国外的一项研究中,直接使用连二亚硫酸钠处理铬渣,当添加量达到理论值的12倍且处理时间为15 d时,测得Cr(Ⅵ)浸出浓度超出美国EPA规定的标准限制(5 mg/L)近5倍[8]。铬渣的化学还原处理在应用中仍存在许多问题:一方面铬渣中的Cr(Ⅵ)通常包裹在由各种矿物组成的内部晶格中,使得Cr(Ⅵ)难以与还原药剂接触进而发生反应;另一方面,铬渣的强碱性会导致重金属发生沉淀、钝化作用,还会使还原剂失效[9]。除了铬渣中Cr(Ⅵ)的传质限制和碱度高等问题外,铬渣处理后还易形成钙矾石导致铬渣体积膨胀,因此需控制反应条件,避免易导致体积膨胀矿物的形成。综上,在对铬渣进行化学还原处理之前,有必要采取措施降低铬渣的碱度、溶解含Cr(Ⅵ)矿物以及导致铬渣体积膨胀的矿物质[10]。
传统的铬渣解毒方法不能有效去除铬渣中的酸溶性Cr(Ⅵ),在CO2和H2O的长期共同作用下,酸溶性Cr(Ⅵ)会慢慢转变为水溶性Cr(Ⅵ)而使渣堆表面呈黄色,解毒不彻底。本研究考虑一方面通过降低铬渣粒径,增加铬渣比表面积,促进表面Cr(Ⅵ)溶出;另一方面通过添加酸促进Cr(Ⅵ)从铬渣内部晶格中释放,破坏含Cr(Ⅵ)矿物的稳定性,减少传质限制和处理后铬渣中Cr(Ⅵ)的残留,最后加入还原药剂将充分溶出的Cr(Ⅵ)彻底还原。铬渣中Cr(Ⅵ)2次溶出,确保了铬渣的解毒效果。本研究探究了铬渣解毒过程的工艺参数,同时分析了解毒机理,对改进铬渣的解毒工艺具有重要意义。
铬渣样品来自甘肃省某铬盐厂长期露天堆放的风化铬渣,风干后放置于密封袋中用于湿法解毒实验。
原始铬渣的主要特征如表1所示,主要元素为Al、Cr、Mg、Fe、Si、Ca等。铬渣为强碱性,pH值为12.67。ICP测试结果显示,铬渣中Cr(Ⅵ)含量约占总Cr含量的30%。
表1 原铬渣样品的化学成分及特性
Table 1 Chemical composition and characteristics of the untreated COPR sample

pH值H2O/%元素组成/(mg/kg)CrAlCaMgFeSi12.676.22210028300165000895005870054800
利用pH计(PB-10,Sartorius,德国)测定样品pH值(样品与水的质量比为1∶2.5)。在X射线衍射仪(D8-Focus,Bruker,德国)上进行XRD分析,将供试样品粉末压片,射线衍射测试条件:CuKα射线,Ni滤波片,管电压40 kV,管电流40 mA,波长1.5418 A,停留时间5 s,步长0.03°。用扫描电子显微镜(QUANTA200,FEI,美国)搭载能谱仪(NexsaX,Thermo Fisher,美国)(SEM-EDS)进行表面形貌观测和表面组成元素分析。
1.3.1 球磨时间试验
称取铬渣试样200 g,设置固液比为1∶1(m(铬渣)∶m(水)),用球磨机分别球磨10,15,20,25 min,球磨后将铬渣浆液倒出,过200目筛(孔径为75 μm),测定筛上物质量,计算球磨后过筛的比率,并测定不同球磨时间下的Cr(Ⅵ)浸出浓度。
1.3.2 硫酸添加量试验
称取7份铬渣试样各200 g,将铬渣球磨20 min后倒出铬渣浆液,设置固液比为1∶4,加入不同质量的浓H2SO4(98%),浓H2SO4与铬渣的质量比分别为10%、20%、30%、40%、50%、60%、70%、80%,酸化搅拌2 h后检测浆液pH值,测定不同H2SO4添加量下的Cr(Ⅵ)浸出浓度。
1.3.3 液固比试验
称取8份铬渣试样各200 g,将铬渣湿式球磨20 min,设置液固比分别为3∶1、4∶1、5∶1、6∶1、7∶1、8∶1、9∶1和10∶1,投加最佳添加量的浓H2SO4形成不同液固比的混合物,充分搅拌2 h,检测浸出液中Cr(Ⅵ)的浓度,计算铬渣中Cr(Ⅵ)的浸出率。
1.3.4 酸化时间试验
称取6份铬渣试样各200 g,将铬渣湿式球磨20 min,设置最佳液固比,向其中加入最佳量H2SO4进行搅拌反应,分别在30,60,90,120,150,180 min时检测浸出液中Cr(Ⅵ)浓度。
1.3.5 硫酸亚铁添加量试验
待Cr(Ⅵ)在最佳条件下充分浸出后,向铬渣中分别加入不同质量的硫酸亚铁(FeSO4·7H2O),其与铬渣质量比分别为15%、20%、25%、30%、35%、40%,搅拌反应6 h,检测反应后铬渣中剩余Cr(Ⅵ)的含量。
Cr(Ⅵ)测定参照GB/T 15555.4—1995《固体废物 六价铬的测定 二苯碳酰二肼分光光度法》,用紫外原子分光光度计(722型可见分光光度计)测定Cr(Ⅵ)浓度,测定前利用铬标准溶液进行标准曲线绘制,测定波长为540 nm。测定后计算浸出液中Cr(Ⅵ)浓度及解毒后铬渣中Cr(Ⅵ)的含量。
Cr(Ⅵ)浸出率计算式为:Cr(Ⅵ)浸出率(%)=溶液中浸出Cr(Ⅵ)的量/铬渣中Cr(Ⅵ)总量。
所有处理均独立重复3次,以其平均值作为测定结果。利用SPSS中单因素方差分析(One-way ANOVA)法研究处理间的差异性,多重比较采用最小显著差异法(LSD),检验显著性水平为0.05,结果以“平均值±标准差”表示。
2.1.1 球磨时间对铬渣细度和Cr(Ⅵ)浸出的影响
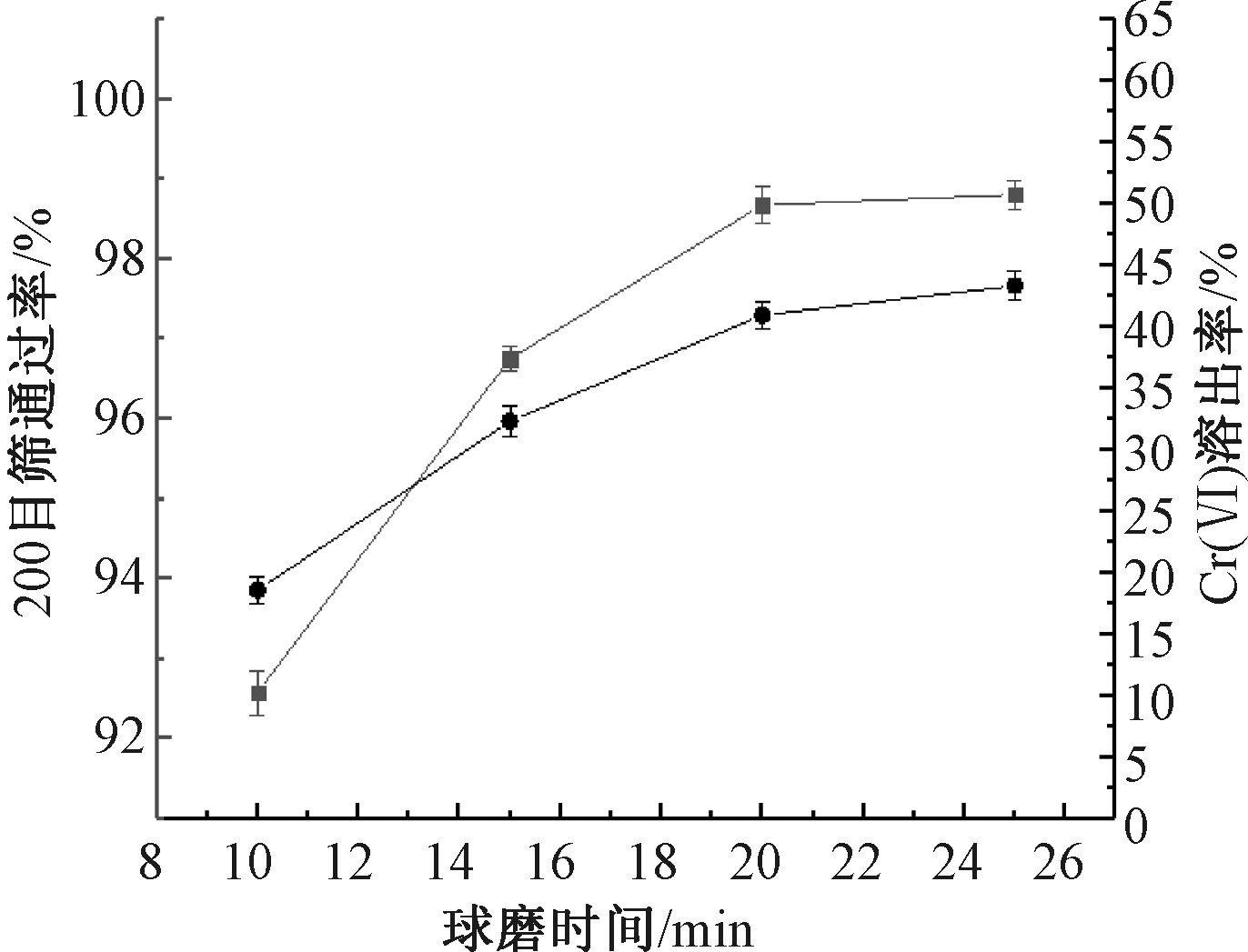
图1显示了球磨时间对铬渣细度和铬渣中Cr(Ⅵ)浸出率的影响。可知:球磨时在液固比1∶1的条件下,球磨细度和Cr(Ⅵ)浸出率均随着球磨时间的增加而上升,当球磨时间由10 min增加到20 min时,铬渣浆液的过筛率(200目筛)由92.58%增加至98.68%,Cr(Ⅵ)的浸出率由18.61%增加至40.96%。而球磨时间超过20 min后铬渣细度与Cr(Ⅵ)浸出率提升有限。
许多研究表明,在添加还原剂之前降低颗粒尺寸有利于提高铬渣处理的有效性。例如,国外一项研究发现[11]:粒径较大(<0.15 mm)的铬渣经过加酸预处理和还原反应后,铬渣中残留的Cr(Ⅵ)含量为1057 mg/kg,而粒径较细(<0.01 mm)的铬渣,经相同条件处理后,铬渣中残留的Cr(Ⅵ)含量为269 mg/kg。铬渣粒径越小,越容易破坏其内部的矿物质晶格,同时会使得铬渣比表面积增大,促进包裹在铬渣矿物中的Cr(Ⅵ)充分释放,释放到溶液中的Cr(Ⅵ)比包裹在矿物中的Cr(Ⅵ)更容易与还原剂发生反应。
![]() —过筛率(200目);
—过筛率(200目); ![]() —Cr(Ⅵ)溶出率。
—Cr(Ⅵ)溶出率。
图1 球磨时间对铬渣细度和Cr(Ⅵ)浸出率的影响
Figure 1 Effect of ball milling time on particle size and leaching rate of Cr(Ⅵ)
2.1.2 H2SO4添加量对Cr(Ⅵ)浸出的影响
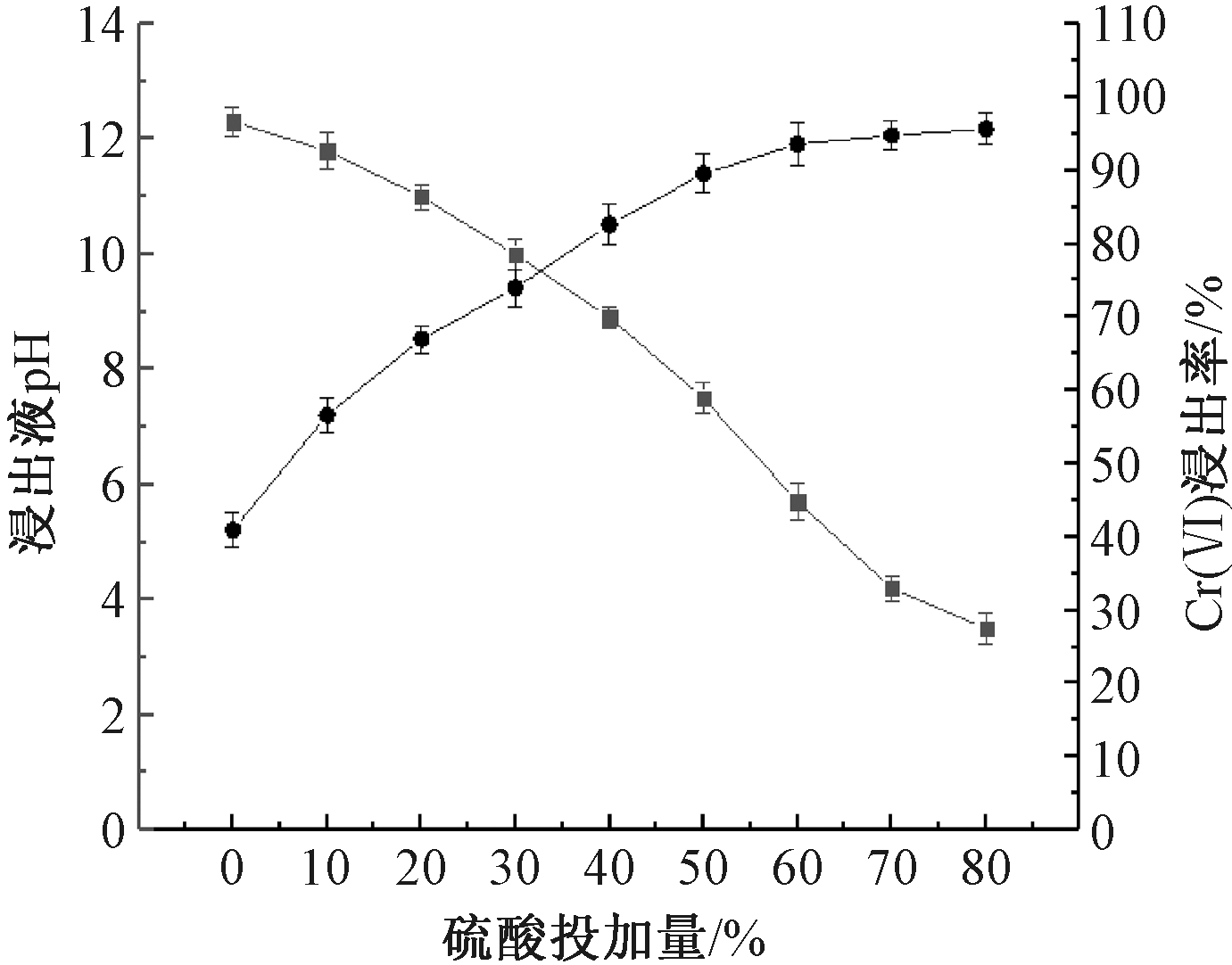
图2显示了球磨后的铬渣在不同H2SO4添加量下的pH以及Cr(Ⅵ)浸出率。可知:在液固比为4∶1,反应时间为2 h时,随着H2SO4添加量的增加,铬渣内部水溶性和酸溶性Cr(Ⅵ)不断溶出,Cr(Ⅵ)浸出率随之增大,同时浸出液pH值不断下降。在未添加H2SO4的情况下,Cr(Ⅵ)浸出率为40.96%,当H2SO4添加量为60%时,Cr(Ⅵ)浸出率达到93.60%,pH由12.3降至5.7。
![]() —浸出率pH;
—浸出率pH; ![]() —Cr(Ⅵ)浸出率。
—Cr(Ⅵ)浸出率。
图2 H2SO4添加量对Cr(Ⅵ)浸出率的影响
Figure 2 Effect of sulfuric acid addition on leaching rate of Cr(Ⅵ)
铬渣浆液中H2SO4添加量增至60%后,继续增加H2SO4添加量,Cr(Ⅵ)浸出率基本不变,浸出液的pH值<6,说明此时包裹Cr(Ⅵ)的矿物已被溶解,铬渣中的Cr(Ⅵ)基本溶出。有研究表明:溶液pH为7.0~9.0时,由于铬渣颗粒表面转化为正电荷,它们会吸附以阴子形式![]() 存在的Cr(Ⅵ),使溶出的Cr(Ⅵ)又回到固相,导致Cr(Ⅵ)浸出率较低;当溶液pH<7.0时,铬渣持续溶解,Cr(Ⅵ)浸出率不断提高[12]。
存在的Cr(Ⅵ),使溶出的Cr(Ⅵ)又回到固相,导致Cr(Ⅵ)浸出率较低;当溶液pH<7.0时,铬渣持续溶解,Cr(Ⅵ)浸出率不断提高[12]。
2.1.3 液固比对Cr(Ⅵ)浸出的影响
图3显示了铬渣浆液的Cr(Ⅵ)浸出率随着固液比的变化。可知:当铬渣球磨时间为20 min,反应时间为2 h,铬渣中H2SO4添加量为60%时,铬渣浆液中的Cr(Ⅵ)浸出率随着液固比的增大呈现先增大后减小的趋势,其变化范围为78.03%~93.60%,在液固比为4∶1时,铬渣浆液中的Cr(Ⅵ)浸出率达到最大。
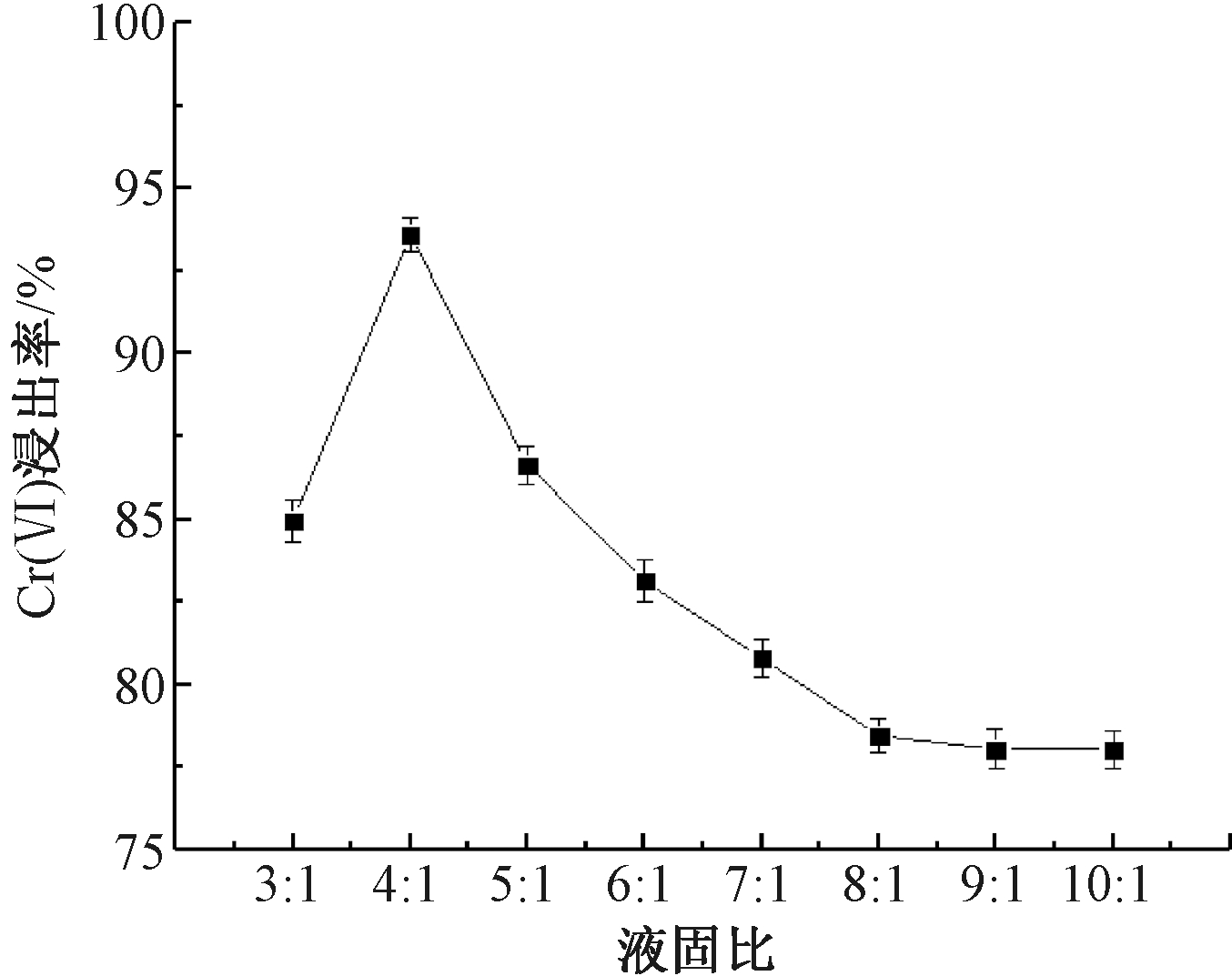
图3 液固比对Cr(Ⅵ)浸出率的影响
Figure 3 Effect of liquid-solid ratio on Cr(Ⅵ) leaching rate
H2SO4浸出铬渣中Cr(Ⅵ)属于液固两相化学反应,当液固比<4∶1时,随着液固比增大,一方面在液相中的铬渣占比减少,分散较为均匀,此时Cr(Ⅵ)从固相进入液相的传质效率高,有利于促进Cr(Ⅵ)浸出;另一方面,铬渣与H2SO4的黏度降低,铬渣与H2SO4能够充分接触,加快Cr(Ⅵ)的浸出速率[13,14]。而随着液固比进一步增大,传质速率对Cr(Ⅵ)浸出的影响较弱,Cr(Ⅵ)的浸出受内扩散控制,主要控速因素为H2SO4浓度,液固比越大,H2SO4的浓度越低,H2SO4与铬渣的反应效率越低,因此继续增大液固比,Cr(Ⅵ)浸出率不再上升。在两段式还原工艺解毒铬渣的试验中,其酸浸阶段液固比对Cr(Ⅵ)浸出率的影响与本研究趋势一致[15]。
2.1.4 酸溶时间对Cr(Ⅵ)浸出的影响
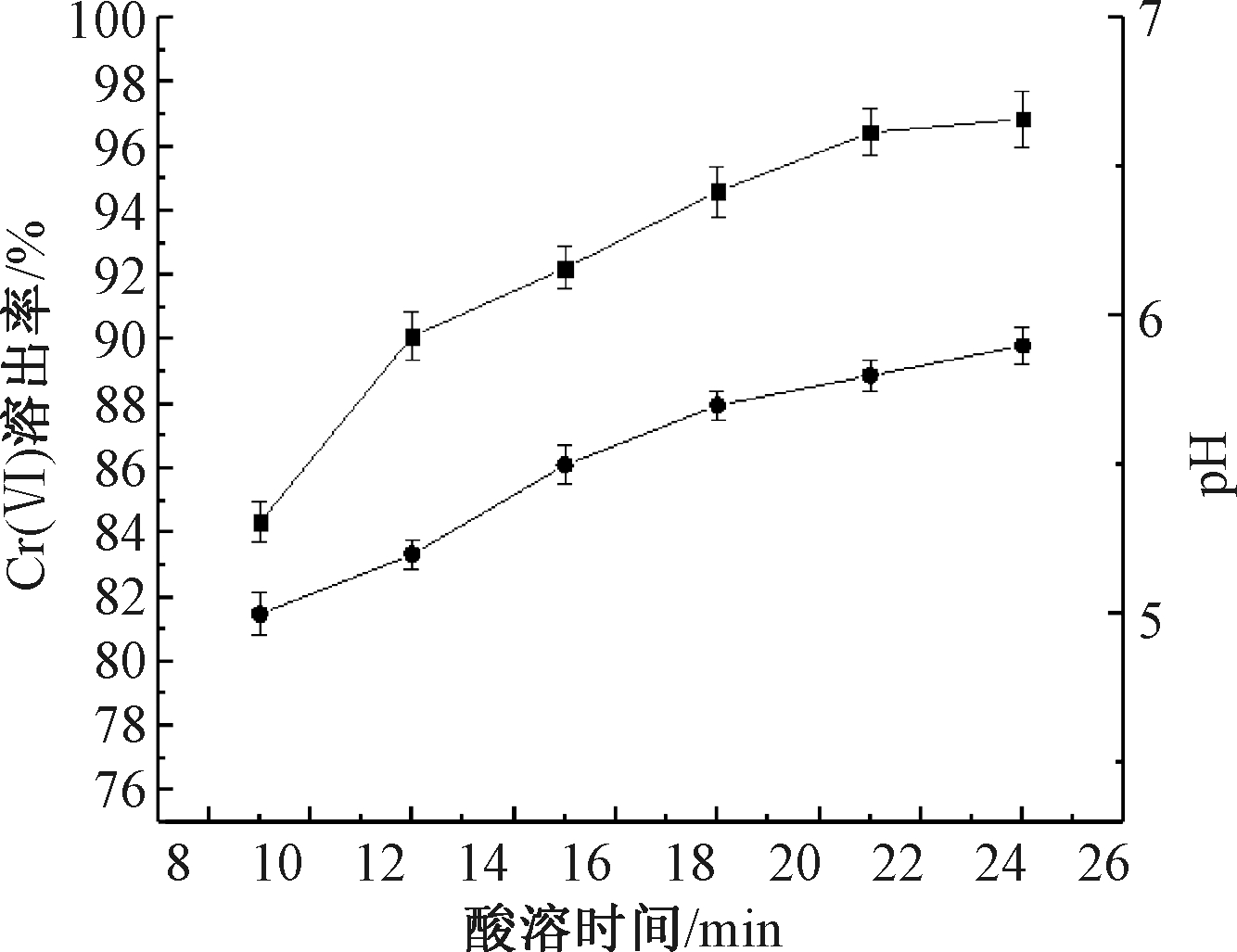
图4显示铬渣浆液中Cr(Ⅵ)的浸出率随着时间的变化情况。可知:当铬渣球磨时间为20 min,未过滤铬渣和过滤后铬渣中H2SO4添加量为60%,液固比为4∶1时,2种铬渣浆液Cr(Ⅵ)的浸出率在反应初始阶段迅速增加,之后逐渐减缓直至不再明显增加。在铬渣中Cr(Ⅵ)浸出初期为快反应阶段,加入H2SO4 0.5 h后,铬渣浆液的Cr(Ⅵ)浸出率达到82.54%,此时pH值为5.0,之后为慢反应阶段,浸出速率减小,浸出率增幅降低,至酸溶时间2.5 h时Cr(Ⅵ)浸出趋于饱和,此时浸出率为95.38%,pH值由5.0上升至5.8。
![]() —Cr(Ⅵ)浸出率;
—Cr(Ⅵ)浸出率; ![]() —pH。
—pH。
图4 酸溶时间对Cr(Ⅵ)浸出率的影响
Figure 4 Effect of acid dissolution time on Cr(Ⅵ) leaching rate
酸溶时间的变化与铬渣中反应物类别有关,快反应物包括水合物和碳酸盐,主要含有水溶性Cr(Ⅵ),可以快速浸出,而慢反应物主要是铁铝酸钙矿石和方镁石等矿物,主要包含酸溶性Cr(Ⅵ),需要较长时间才能浸出完全[11]。此外,H2SO4浓度也会对Cr(Ⅵ)浸出速率造成影响,在初始阶段,H2SO4浓度较高有利于含Cr(Ⅵ)矿物的溶解,但随着反应时间的增加,H2SO4不断被消耗,酸溶性Cr(Ⅵ)的浸出速率下降。另外在反应过程中,形成的固体产物层厚度增大,内扩散作用对反应速率的限制也越显著。
2.1.5 硫酸亚铁添加量对Cr(Ⅵ)处理效果的影响
图5显示了硫酸亚铁添加量对铬渣浆液Cr(Ⅵ)处理效果的影响。可知:当铬渣球磨时间为20 min,铬渣浆液中H2SO4添加量为60%,液固比为4∶1,酸化时间为2.5 h时,加入硫酸亚铁还原熟化6 h后,铬渣中残余的Cr(Ⅵ)含量。可见,硫酸亚铁添加量由15%增加到40%,铬渣中Cr(Ⅵ)含量由53.19 mg/kg下降至1.38 mg/kg。
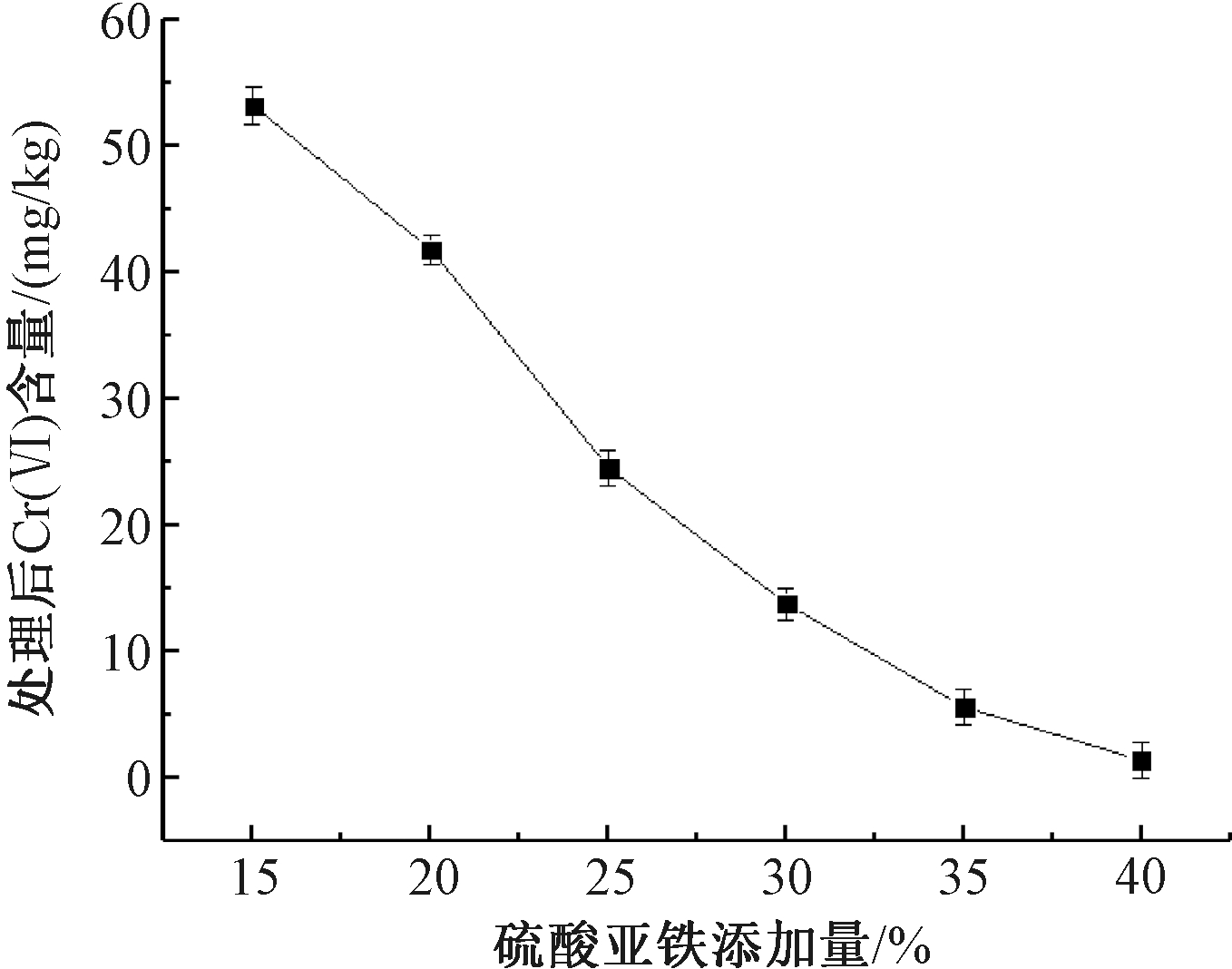
图5 硫酸亚铁添加量对处理效果的影响
Figure 5 Effect of ferrous sulfate addition on treatment efficiency
2.2.1 铬渣的矿物组成
图6为经过酸溶和FeSO4处理后铬渣样品XRD图谱。XRD图谱共鉴定了多种矿物相,这些矿物相可以分为3类:1)未反应矿,包括铬铁矿;2)在高温焙烧过程中产生的矿物,包括铁铝酸钙矿石(4CaO·Al2O3·Fe2O3)、方镁石(MgO);3)环境风化过程中产生的矿物,包括水镁石(Mg(OH)2)、方解石(CaCO3)、羟钙石(Ca(OH)2)、水滑石(Mg6Al2(OH)16CO3·4H2O)、钙矾石(Ca6Al2(SO4)3(OH)12·26H2O)等[16,17]。有研究表明:Cr(Ⅵ)在强碱条件下容易与矿物结构相结合,而钙矾石和水滑石的晶体结构特征有利于与Cr(Ⅵ)的结合和固定,是与Cr(Ⅵ)结合的主要矿物[18,19]。
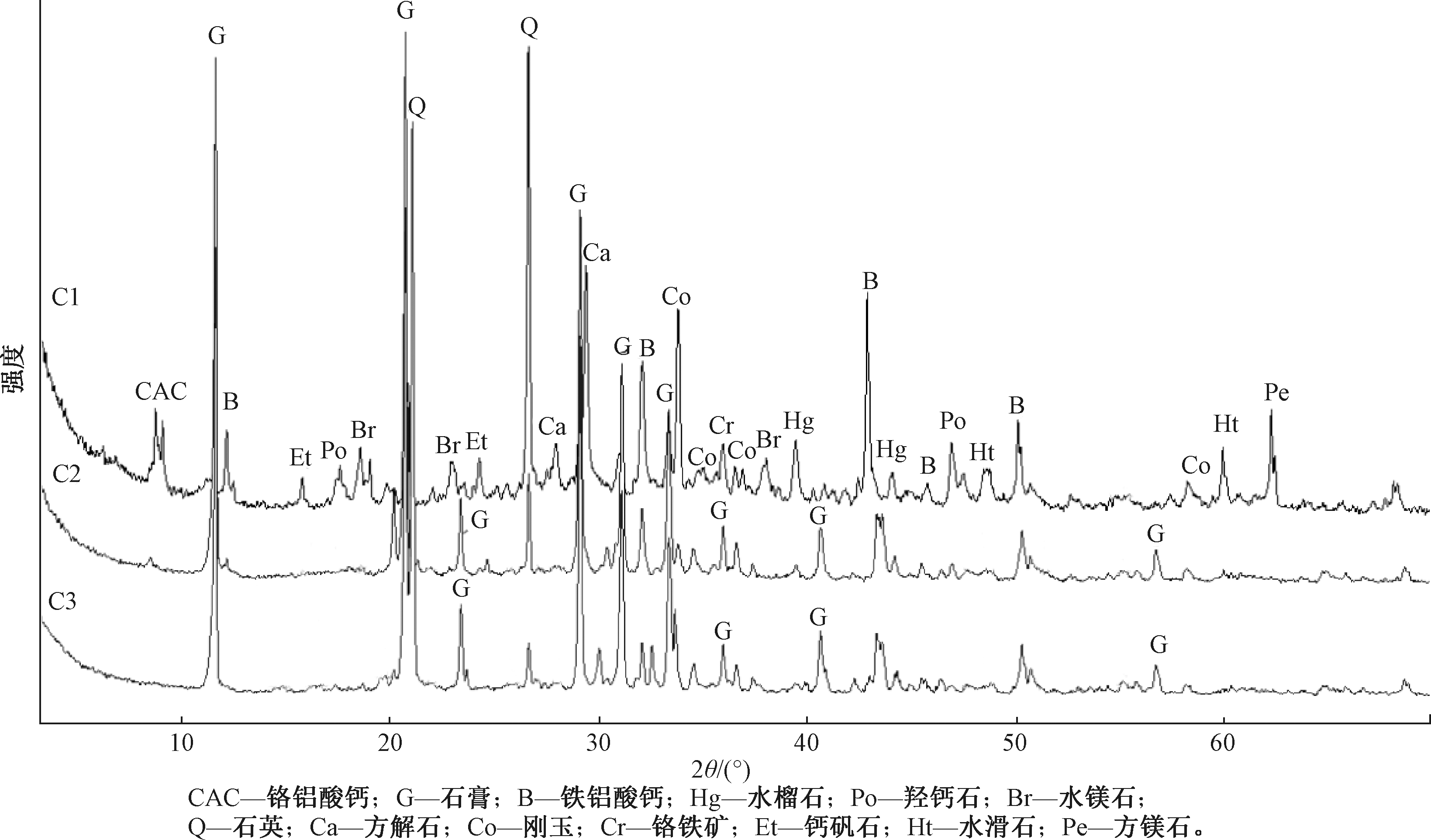
C1—原始铬渣; C2—酸溶后的铬渣; C3—硫酸亚铁还原后的铬渣。
图6 铬渣酸溶及还原前后的XRD图谱
Figure 6 XRD patterns of chromium residue before and after acid solution and reduction
由图6可看出:铬渣经过酸溶后,矿物大量溶解,铁铝酸钙矿石含量下降,波峰明显削弱,而方解石、水滑石、水镁石、水榴石、羟钙石、钙矾石等矿物相则消失。另外,经过酸溶后的样品中,石膏的波峰均明显增强,说明硫酸的加入有利于石膏形成[20]。在硫酸亚铁处理过的铬渣图谱中,未发现FexCr(1-x)(OH)3和Cr(OH)3矿物相,表明生成Cr(Ⅲ)的氢氧化物是无定形的非结晶相。
2.2.2 铬渣的表面形貌变化
原始铬渣表面致密,整体块状结构,其对应的能谱图显示含有较多的Mg、Ca、Si、Cr、Fe等无机矿物。经过球磨以及酸溶以后,铬渣结构较为破碎松散,表面变得疏松,铬渣内部的矿物相被溶解破坏,与XRD的表征结果一致,详见图7。因此,采用球磨加酸溶浸出铬渣可以保证铬渣中Cr(Ⅵ)的最大浸出率。铬渣经FeSO4还原后表面更为破碎,形成了一些非晶态物质。
铬渣是1种典型的复合胶结体,其包含许多结晶相和非结晶相[21]。铬渣具有强碱性,其固体表面容易发生脱质子化作用,![]() 需要与固体表面更丰富的OH-争夺吸附位点,导致其很难吸附在铬渣表面[22,23]。因此,
需要与固体表面更丰富的OH-争夺吸附位点,导致其很难吸附在铬渣表面[22,23]。因此,![]() 在结构上一般与钙矾石、水滑石、水镁石等矿物相结合[24,25]。有研究表明,Cr(Ⅵ)的释放过程主要包括含Cr(Ⅵ)矿物的酸溶、矿物和金属氢氧化物外表面的阴离子交换以及金属氢氧化物的解吸[26]。然而由于传质条件的限制,各种矿物相只能缓慢地释放出OH-和Cr(Ⅵ)[27],H2SO4的加入可以加速OH-和Cr(Ⅵ)由固相向液相的传质。由于铬渣含有的水钙石、水镁石、方解石等矿物在溶解时会释放OH-,因此其具有很强的酸中和能力,需要加入大量酸以调节铬渣的pH值。随着H2SO4的加入,溶液的酸性不断增强,铬渣中的矿物质不断溶解,其吸附的Cr(Ⅵ)释放到溶液中,从而导致浸出液中Cr(Ⅵ)浓度不断增加[28]。
在结构上一般与钙矾石、水滑石、水镁石等矿物相结合[24,25]。有研究表明,Cr(Ⅵ)的释放过程主要包括含Cr(Ⅵ)矿物的酸溶、矿物和金属氢氧化物外表面的阴离子交换以及金属氢氧化物的解吸[26]。然而由于传质条件的限制,各种矿物相只能缓慢地释放出OH-和Cr(Ⅵ)[27],H2SO4的加入可以加速OH-和Cr(Ⅵ)由固相向液相的传质。由于铬渣含有的水钙石、水镁石、方解石等矿物在溶解时会释放OH-,因此其具有很强的酸中和能力,需要加入大量酸以调节铬渣的pH值。随着H2SO4的加入,溶液的酸性不断增强,铬渣中的矿物质不断溶解,其吸附的Cr(Ⅵ)释放到溶液中,从而导致浸出液中Cr(Ⅵ)浓度不断增加[28]。
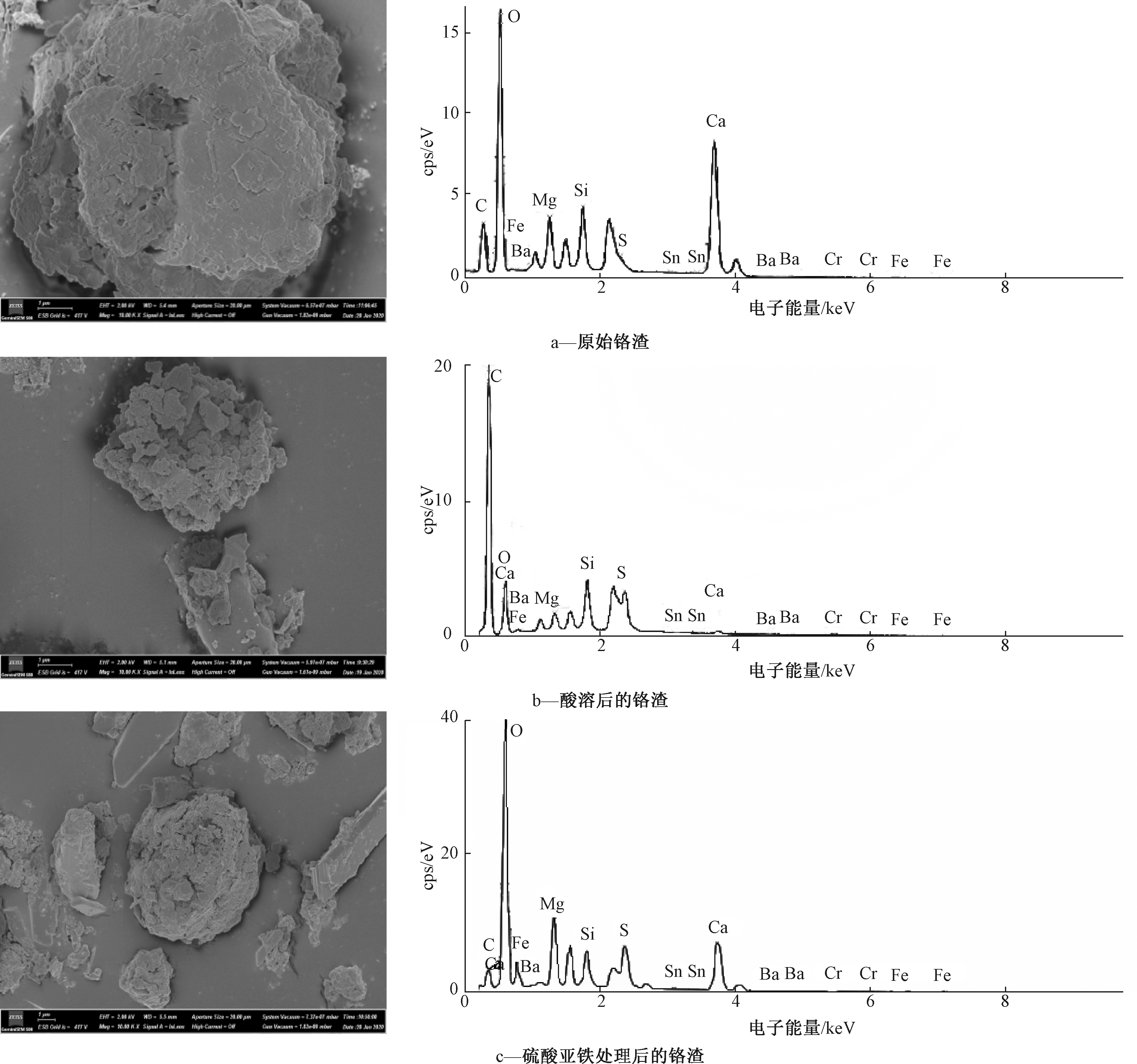
图7 铬渣酸溶及还原前后的SEM-EDS谱图
Figure 7 SEM-EDS spectras of chromium residue before and after acid dissolution and reduction
加入H2SO4后,H+和![]() 均可以促进铬渣中Cr(Ⅵ)的释放。H+可以破坏铬渣的矿物结构,促进矿物溶解[29],这与XRD(图6)和SEM(图7)的表征结果相吻合,添加H2SO4后钙矾石、水钙石、水镁石和方解石的波峰强度均明显减弱。这些矿物中都含有Cr(Ⅵ)或者可以与Cr(Ⅵ)相结合[30,31,32],且在pH为9.5~11时较为稳定,加入H2SO4后,pH不断下降,矿物不断溶解,促进了Cr(Ⅵ)的溶出。此外,H+能促进
均可以促进铬渣中Cr(Ⅵ)的释放。H+可以破坏铬渣的矿物结构,促进矿物溶解[29],这与XRD(图6)和SEM(图7)的表征结果相吻合,添加H2SO4后钙矾石、水钙石、水镁石和方解石的波峰强度均明显减弱。这些矿物中都含有Cr(Ⅵ)或者可以与Cr(Ⅵ)相结合[30,31,32],且在pH为9.5~11时较为稳定,加入H2SO4后,pH不断下降,矿物不断溶解,促进了Cr(Ⅵ)的溶出。此外,H+能促进![]() 离子转化成氧化性更强的离子(图8),有利于溶液中Cr(Ⅵ)的还原转化[33]。
离子转化成氧化性更强的离子(图8),有利于溶液中Cr(Ⅵ)的还原转化[33]。
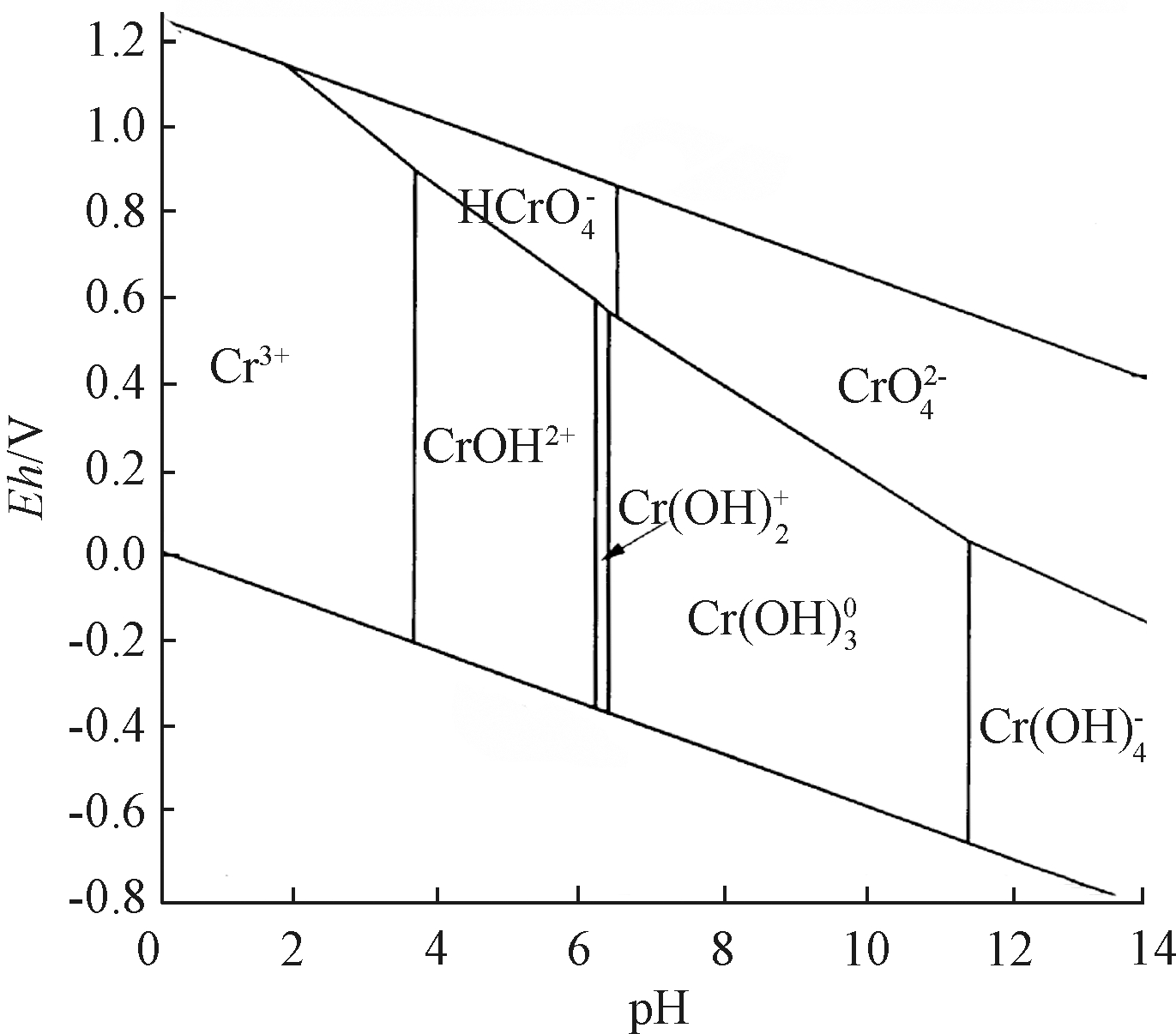
图8 铬在不同pH下的存在形态及氧化还原电位[34]
Figure 8 Morphology and Eh of chromium at different pH values[34]
除了H+对铬渣中矿物的溶解破坏作用,![]() 也起到了促进铬渣内部Cr(Ⅵ)释放的作用。
也起到了促进铬渣内部Cr(Ⅵ)释放的作用。![]() 和
和![]() 的电荷和大小均相似,因此
的电荷和大小均相似,因此![]() 优先从矿物和金属氢氧化物的外表面交换
优先从矿物和金属氢氧化物的外表面交换![]() 有研究表明,在相同的H+添加量下,与HCl相比,利用H2SO4处理铬渣增加了19%的Cr(Ⅵ)溶出率。此外,当使用NaCl作为浸提剂时,从铬渣中释放出的Cr(Ⅵ)的比例仅为49.5%,而使用相同添加量的Na2SO4作为浸提剂时,释放出的Cr(Ⅵ)的比例为74.7%,增加了25.2%百分点[35]。因此,
有研究表明,在相同的H+添加量下,与HCl相比,利用H2SO4处理铬渣增加了19%的Cr(Ⅵ)溶出率。此外,当使用NaCl作为浸提剂时,从铬渣中释放出的Cr(Ⅵ)的比例仅为49.5%,而使用相同添加量的Na2SO4作为浸提剂时,释放出的Cr(Ⅵ)的比例为74.7%,增加了25.2%百分点[35]。因此,![]() 更利于铬渣中的Cr(Ⅵ)的释放和去除。
更利于铬渣中的Cr(Ⅵ)的释放和去除。
利用Fe(Ⅱ)还原Cr(Ⅵ)主要基于反应式(1):
![]()
(1)
采用FeSO4处理铬渣,一方面在含Cr(Ⅵ)矿物中,![]() 更易于与
更易于与![]() 发生离子交换作用,促进Cr(Ⅵ)的浸出;另一方面,如式(1)所示,在反应过程中会通过释放H+,降低反应体系的pH值,从而促进Cr(Ⅵ)的还原,这是因为Cr(Ⅵ)在酸性条件下具有较强的氧化性。此外,
发生离子交换作用,促进Cr(Ⅵ)的浸出;另一方面,如式(1)所示,在反应过程中会通过释放H+,降低反应体系的pH值,从而促进Cr(Ⅵ)的还原,这是因为Cr(Ⅵ)在酸性条件下具有较强的氧化性。此外,![]() 电对的标准电极电位为1.33 V,而Fe(Ⅲ)/Fe(Ⅱ)电对的标准电极电位为0.77 V,二者相差越大,对重金属的还原反应越彻底。Fe(Ⅱ)将Cr(Ⅵ)还原后形成的Fe(Ⅲ)-Cr(Ⅲ)氢氧化物是铁素体结构,比无定形的Cr(Ⅲ)氢氧化物更加稳定。
电对的标准电极电位为1.33 V,而Fe(Ⅲ)/Fe(Ⅱ)电对的标准电极电位为0.77 V,二者相差越大,对重金属的还原反应越彻底。Fe(Ⅱ)将Cr(Ⅵ)还原后形成的Fe(Ⅲ)-Cr(Ⅲ)氢氧化物是铁素体结构,比无定形的Cr(Ⅲ)氢氧化物更加稳定。
综上所述,铬渣解毒机理主要为首先通过加酸溶解含Cr(Ⅵ)矿物,使其释放到液相中,同时,![]() 和
和![]() 在水钙石和水滑石等矿物和金属氢氧化物的表面发生离子交换,将Cr(Ⅵ)从铬渣固体中释放到溶液中。最后,溶液中的Cr(Ⅵ)被Fe(Ⅱ)还原为Cr(Ⅲ),在环境中形成低毒性、低溶解性和低迁移性的FexCr(1-x)(OH)3沉淀。
在水钙石和水滑石等矿物和金属氢氧化物的表面发生离子交换,将Cr(Ⅵ)从铬渣固体中释放到溶液中。最后,溶液中的Cr(Ⅵ)被Fe(Ⅱ)还原为Cr(Ⅲ),在环境中形成低毒性、低溶解性和低迁移性的FexCr(1-x)(OH)3沉淀。
1)球磨细度和Cr(Ⅵ)浸出率均随着球磨时间的增加而上升,球磨时间为20 min,铬渣颗粒98.68%可过200目筛时,水溶性Cr(Ⅵ)的浸出率为40.96%。
2)铬渣硫酸添加量为60%,液固比为4∶1,酸溶时间为2.5 h时,Cr(Ⅵ)浸出趋于饱和,此时浸出终点pH为5.8,水溶性和酸溶性Cr(Ⅵ)总浸出率为95.38%。
3)FeSO4添加量为40%时,Cr(Ⅵ)含量下降至1.38 mg/kg。
4)铬渣解毒机理主要为首先通过加酸溶解含Cr(Ⅵ)矿物,同时![]() 和
和![]() 发生离子交换,将Cr(Ⅵ)从铬渣固体中释放到溶液中。最后,溶液中的Cr(Ⅵ)被还原为Cr(Ⅲ),在环境中形成低毒性、低溶解性和低迁移性的FexCr(1-x)(OH)3沉淀。
发生离子交换,将Cr(Ⅵ)从铬渣固体中释放到溶液中。最后,溶液中的Cr(Ⅵ)被还原为Cr(Ⅲ),在环境中形成低毒性、低溶解性和低迁移性的FexCr(1-x)(OH)3沉淀。
[1] LI Y Y, LIANG J L, YANG Z H, et al. Reduction and immobilization of hexavalent chromium in chromite ore processing residue using amorphous FeS2[J]. Science of the Total Environment, 2019, 658: 315-323.
[2] 陈滨宇. 解毒铬渣堆放场周围环境铬污染规律研究[J]. 环境科学与技术, 1989, 47(4): 8-10.
[3] WAZNE M, JAGUPILLA S C, MOON D H, et al. Assessment of calcium polysulfifide for the remediation of hexavalent chromium in chromite ore processing residue (COPR)[J]. Journal of Hazardous Materials, 2007, 143(3): 620-628.
[4] MOON D H, WAZNE M, DERMATAS D, et al. Long-term treatment issues with hromite ore processing residue (COPR): Cr6+ reduction and heave [J]. Journal of Hazardous Materials, 2007, 143(3): 629-635.
[5] 荣伟英, 周启星. 铬渣堆放场地土壤的污染过程、影响因素及植物修复[J]. 生态学杂志, 2010, 29(3): 598-604.
[6] DERMATAS D, CHRYSOCHOOU M, MOON D H, et al. Ettringite-induced heave in hromite ore processing residue (COPR) upon ferrous sulfate treatment[J]. Environmental Science & Echnology, 2006, 40(18): 5786-5792.
[7] 盛灿文, 柴立元, 王云燕,等. 铬渣的湿法解毒研究现状及发展前景[J]. 工业安全与环保, 2006, 32(2): 1-3.
[8] LI Y Y, CUNDY A B, FENG J X, et al. Remediation of hexavalent chromium contamination in chromite ore processing residue by sodium dithionite and sodium phosphate addition and its mechanism[J]. Journal of Environmental Management, 2017, 192: 100-106.
[9] JAGUPILLA S C, WAZNE M, MOON D H. Assessment of ferrous chloride and Portland cement for the remediation of chromite ore processing residue[J]. Chemosphere, 2015, 136: 95-101.
[10] GEELHOED J S, MEEUSSEN J C N, ROE M J, et al. Effect of iron(Ⅱ) sulfate addition on chromium(Ⅵ) leaching from columns of chromite ore processing residue[J]. Environmental Science & Technology, 2003, 37 (14): 3206-3213.
[11] JAGUPILLA S C, MOONA D H, WAZNE M, et al. Effects of particle size and acid addition on the remediation of chromite ore processing residue using ferrous sulfate[J]. Journal of Hazardous Materials, 2009, 168: 121-128.
[12] 宋艳, 杨志平, 康绍辉,等. 铬渣中Cr(Ⅵ)的浸出及还原试验研究[J]. 湿法冶金, 2017, 36(5):380-383.
[13] 斯塔姆 W, 摩尔根 J. 水化学: 天然水体化学平衡导论[M]. 汤鸿霄,译. 北京:科学出版社, 1987, 129-134.
[14] JAGANYI D, WHEELER P J. Rooibos tea: equilibrium and extraction kinetics of aspalathin[J]. Food Chemistry, 2003, 83: 121-126.
[15] 刘帅霞. 两段式还原工艺解毒铬渣技术研究[D]. 上海:东华大学, 2013.
[16] MATERN K, KLETTI H, MANSFELDT T. Chemical and mineralogical characterization of chromite ore processing residue from two recent Indian disposal sites[J]. Chemosphere, 2016, 155: 188-195.
[17] YAO S, JING L, MIAO P, et al. Identification of Cr(Ⅵ) speciation in ferrous sulfate-reduced chromite ore processing residue (rCOPR) and impacts of environmental factors erosion on Cr(Ⅵ) leaching [J]. Journal of Hazardous Materials, 2019, 373: 389-396.
[18] CHRYSOCHOOU M, DERMATAS D. Application of the Rietveld method to assess chromium(Ⅵ) speciation in chromite ore processing residue[J]. Journal of Hazardous Materials, 2007, 141(2): 370-377.
[19] GUO B, SASAKI K, HIRAJIMA T, et al. Selenite and selenate uptaken in ettringite: immobilization mechanisms, coordination chemistry, and insights from structure[J]. Cement Concrete Research, 2017, 100: 166-175.
[20] PAPASSIOPI N, VAXEVANIDOU K, CHRISTOU C, et al. Synthesis, characterization and stability of Cr(Ⅲ) and Fe(Ⅲ) hydroxides[J]. Journal of Hazardous Materials, 2014, 264: 490-497.
[21] MILLS C T, BERN C R, WOLF R E, et al. Modifications to EPA method 3060A to improve extraction of Cr(Ⅵ) from chromium ore processing residue-contaminated soils[J]. Enviromental Science & Technology, 2017, 51(19): 11235-11243.
[22] KARAMALIDIS A K, VOUDRIAS E A. Anion leaching from refinery oily sludge and ash from incineration of oily sludge stabilized/solidified with cement[J]. Environmental Science & Technology, 2008, 42(16): 6124-6130.
[23] GLASSER F P. Fundamental aspects of cement solidification and stabilisation[J]. Journal of Hazardous Materials, 1997, 52(2/3): 151-170.
[24] HILLIER S, ROE M J, GEELHOED J S, et al. Role of quantitative mineralogical analysis in the investigation of sites contaminated by chromite ore processing residue[J]. Science of the Total Environment, 2003, 308(1/2/3): 195-210.
[25] WU J N, LI C L, YANG F. The disposition of chromite ore processing residue (COPR) incorporating industrial symbiosis[J]. Journal of Cleaner Production, 2015, 95: 156-162.
[26] TINJUM J M, BENSON C H, EDIL T B. Mobilization of Cr(Ⅵ) from chromite ore processing residue through acid treatment[J]. The Science of the Total Environment, 2008, 391(1): 13-25.
[27] VELASCO A, RAM REZ M, HERN
REZ M, HERN NDEZ S, et al. Pilot scale treatment of chromite ore processing residue using sodium sulfide in single reduction and coupled reduction/stabilization processes[J]. Journal of Hazardous Materials, 2012, 207/208: 97-102.
NDEZ S, et al. Pilot scale treatment of chromite ore processing residue using sodium sulfide in single reduction and coupled reduction/stabilization processes[J]. Journal of Hazardous Materials, 2012, 207/208: 97-102.
[28] YANG H S, CHE Y J, LENG F G. Calcium leaching behavior of cementitious materials in hydrochloric acid solution[J]. Scientific Reports, 2018, UK 8.
[29] WAZNE M, JAGUPILLA S C, MOON D H, et al. Leaching mechanisms of Cr(Ⅵ) from chromite ore processing residue[J]. Journal of Environmental Quality, 2008, 37(6): 2125-2134.
[30] CHRYSOCHOOU M, FAKRA S C, MARCUS M A, et al. Microstructural analyses of Cr(Ⅵ) speciation in chromite ore processing residue (COPR)[J]. Environmental Science & Technology, 2009, 43(14): 5461-5466.
[31] MOON D H, WAZNE M, DERMATAS D, et al. Evaluation of ettringite-related swelling mechanisms for treated chromite ore processing residue[J]. Environmental Science and Pollution Research International, 2015, 22(1): 738-744.
[32] 徐文彬.铬渣解毒与氧化铬清洁制备工艺的研究[D].长沙:中南大学,2011.
[33] PALMER C D, WITTBRODT P R. Processes affecting the remediation of chromium-contaminated sites[J]. Environmental Health Perspectives, 1991, 92: 25-40.
[34] WANG X, ZHANG J D, WANG L L, et al. Long-term stability of FeSO4 and H2SO4 treated chromite ore processing residue (COPR): importance of H+ and ![]() Journal of Hazardous Materials, 2017, 321: 720-727.
Journal of Hazardous Materials, 2017, 321: 720-727.