0 引 言
沉水植物是健康水生态系统的重要组成部分[1,2],其生长过程中会大量吸收水体和底泥中的营养盐,缓解水体富营养化进程[3]。沉水植物是湖泊营养循环的核心环节[4],可有效去除水体中的氮、磷及其他污染物,提高水体透明度,促进水体环境的改善[5-6],重建以沉水植物为主的水生植被对富营养化浅水湖泊的恢复至关重要,但由于沉水植物生长具有周期性,植物残体未及时收集,在水生态系统中快速腐解,会向水体中释放大量氮、磷[7-10]。
目前,国内外对于沉水植物腐解期的研究更多地集中于氮、磷的释放或外部环境因子对腐解的影响[11],而对整个沉水植物系统腐解期内磷的迁移转化研究较少,这难以真实反映自然状态下沉水植物衰亡过程;因此,研究沉水植物腐解对水-底泥-黑藻系统磷素的迁移转化,能够为浅水湖泊植物生物量调控提供基础资料,从而为防治沉水植物腐解对湖泊水体造成二次污染提供理论支撑。
沉水植物黑藻[Hydrilla verticillata (Linn.f.)Royle],作为我国许多浅水湖泊的本土优势植物,被认为是在控制富营养化过程中恢复水生植物的先锋物种[12,13]。我国南方大部分水域黑藻虽然在秋、冬寒冷季节开始衰亡,但由于冬季水温较低,此时黑藻植物体腐解较为缓慢,大量营养物质仍保留在植物残体中,直至翌年初春回暖[14,15]。因此本实验在步入式模拟实验室内模拟太湖初春时环境,以常见沉水植物黑藻为材料,对其腐解过程进行了为期约70 d的监测。以水体-底泥-黑藻系统为研究主体,全面研究黑藻腐解过程释放磷元素的具体情况,以及对水体沉积物-水界面处各种环境因子造成的影响,以期为浅水湖泊生物量调控提供数据参考。
1 实验部分
1.1 实验材料
实验所用黑藻由养殖户处购买,后移植到装有太湖水体和底泥的容器中自然状态下培养2周,使其状态更加接近自然生长的黑藻(株高50 cm左右)。黑藻经过清洗后在阴凉处沥干水,之后在实验开始前预先放入零度冰箱冷冻1周杀死。
底泥采自太湖竺山湾。采集后的底泥经过去除粗粒及动植物残体、冷冻干燥、研磨过筛(100 目筛)后,充分混匀作为实验用底泥(ρ(TN)=1.62 mg/g,ρ(TP)=0.82 mg/g),平均分装到各实验容器中;实验用水采用超纯水。
1.2 实验设计
实验装置为聚乙烯塑料桶,内径为17 cm,高为50 cm,实验装置内底泥厚10 cm,上覆水高40 cm。实验用黑藻以每份鲜重30,60 g分装到尼龙袋内,实验开始时投入实验装置中并下沉到沉积物-水界面处。
步入式模拟实验室(温度:7~17 ℃;光照强度:0~57500 lux)内进行黑藻腐解实验,共设置:1)对照组:底泥+上覆水+0 g黑藻;2)30 g黑藻组:底泥+上覆水+ 30 g黑藻;3)60 g黑藻组:底泥+上覆水+ 60 g黑藻。
1.3 分析指标
测定指标分别为水体中pH值、溶解氧(DO)和氧化还原电位(ORP),水体中总磷(TP)和无机磷(IP)浓度;底泥中TP浓度、IP浓度和底泥脱氢酶活性(DHA);黑藻生物量、黑藻中TP浓度和IP浓度。DO采用YSI DO200 便携式溶解氧仪测定;pH和ORP采用Mettler-Toledo Seven Go pro pH/离子(IP67)便携式多功能检测仪测定;水体TP采用硫酸消解-磷钼蓝比色法测定;水体IP采用磷钼蓝比色法测定。底泥TP采用马弗炉灰化盐酸提取-磷钼蓝比色法测定;底泥IP采用磷钼蓝比色法测定;底泥DHA采用INT-DHA法检测。黑藻中TP和IP采用磷钼蓝比色法测定。有机磷(OP)含量为TP含量减IP含量。以上测定方法涉及的具体操作参照相关文献资料进行[16-21]。
2 结果与讨论
2.1 黑藻生物量变化
黑藻生物量变化如图1所示。可知:随时间的增加,黑藻的生物量逐渐减少,黑藻腐解具有明显的阶段性,实验初期分解速率明显高于实验中后期,实验开始的0~7 d黑藻快速腐解,之后分解速率逐渐降低,56 d后趋于稳定,处于较低水平。经过70 d的分解,30 g黑藻组黑藻残体剩余质量为初始时的23.44%,60 g时为初始时的23.84%,分解掉了自身将近80%的物质。

![]() 30 g;
30 g; ![]() 60 g。
60 g。
图1 黑藻生物量的变化
Figure 1 Changes of biomass of Hydrilla verticillata
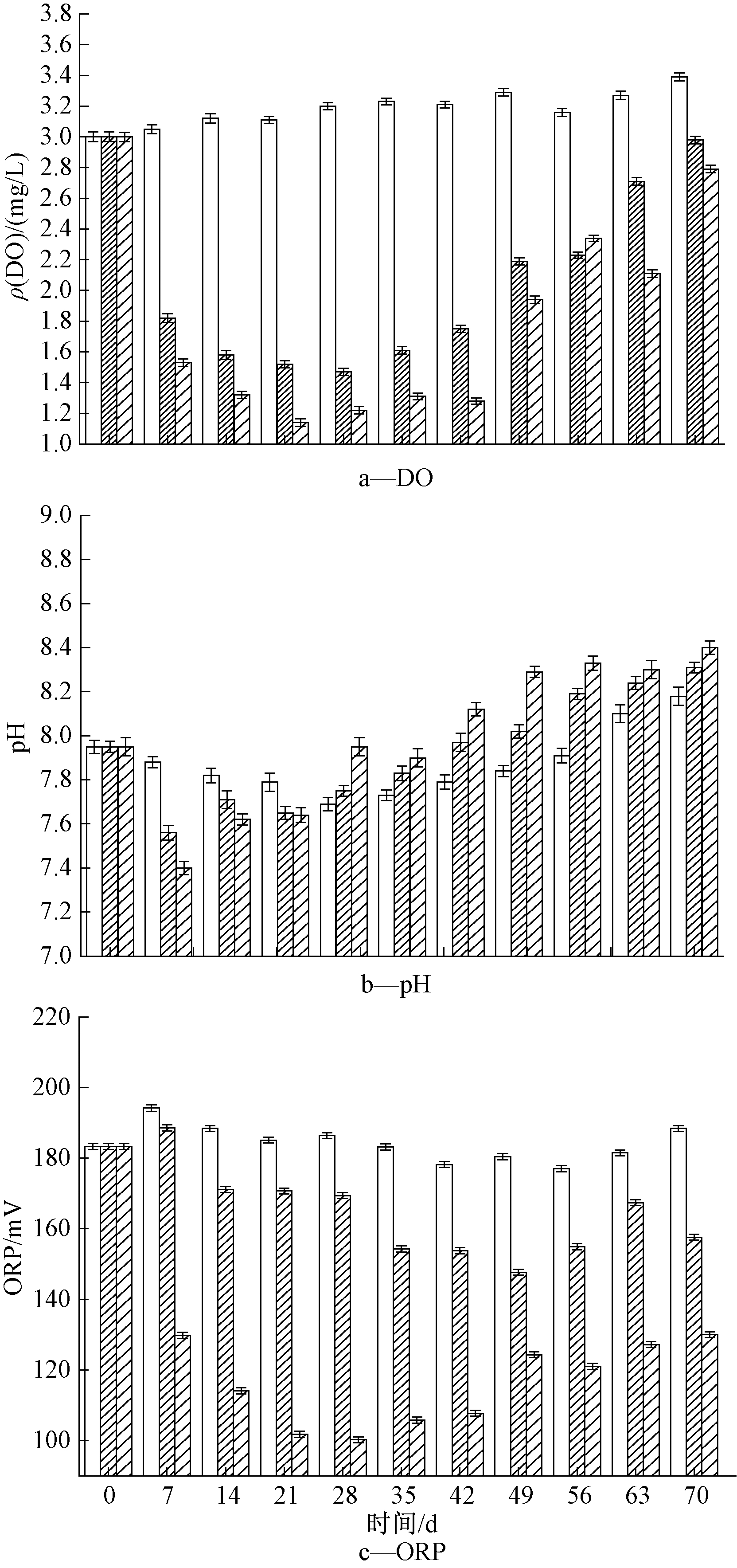
2.2 水体中DO、pH及ORP的变化
黑藻腐解对水体中DO含量影响较为明显,由图2a可知:两黑藻组实验21 d内DO含量一直处于下降趋势,60 g黑藻组在21~40 d保持一个相对稳定的低水平阶段,40 d后DO有明显上升趋势,而30 g黑藻组21 d之后DO含量保持回升趋势,这可能与黑藻腐解速率变化有关,腐解速率的降低使得耗氧速率降低,从而使得水体中DO浓度回升。
![]() 0 g;
0 g; ![]() 30 g;
30 g; ![]() 60 g。
60 g。
图2 水体pH值、DO及ORP的变化
Figure 2 Changes of water environmental physical factors: DO content, pH, and ORP value
由图2b可知:黑藻组与对照组的pH值在实验期间整体区别不大,变化区间均在7.4~8.4,对照组pH在实验期间略有轻微下降,黑藻组在实验期间pH呈先下降后上升趋势,分析原因可能是沉水植物腐烂初期,一方面腐解速率大,水体内有机物迅速增加,在微生物作用下分解并释放出CO2,导致水体中pH值下降;另一方面植物体中的蛋白质被微生物分解后产生大量的有机酸,也导致水体pH值下降,随后由于有机酸的分解导致水体酸度降低,又引起pH值上升[22,23]。黑藻组水体中pH在实验期总体呈弱碱性,相关研究表明,碱性环境有利于底泥对磷的吸收,通过络合沉淀、被底泥所吸附或者被其中的微生物吸收[24,25]沉积在底泥中,吸收量和吸收速率随pH值升高而升高[26,27],这说明黑藻的腐解会促进水-底泥-沉水植物系统中水体的磷向底泥迁移。
由图2c可知:对照组与30 g黑藻组中ORP总体呈先上升再下降趋势,60 g黑藻组呈先下降后上升趋势。对照组和30 g黑藻组,实验初期ORP稍有上升,可能是由实验开始前底泥及水体中带入的DO及被空气氧化的沉积物等氧化性物质造成,60 g黑藻组初期呈下降趋势,可能是因为60 g黑藻组腐解量大,对ORP的影响掩盖了实验开始前底泥及水体中带入的DO及被空气氧化的沉积物等氧化性物质造成的影响。
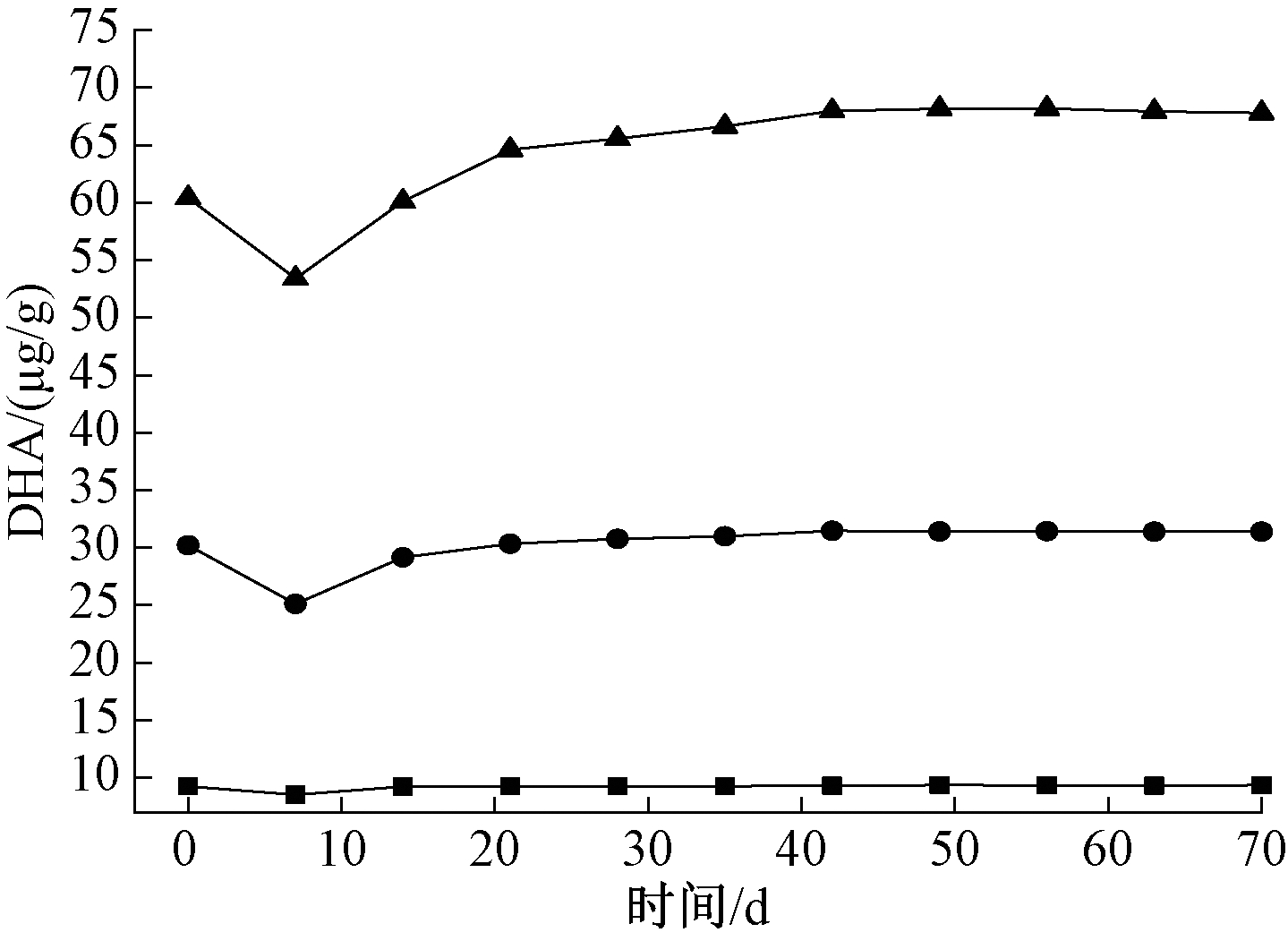
2.3 沉积物中脱氢酶活性(DHA)的变化
DHA用来表征ETS的脱氢能力,体现底泥中总生物量的脱氢酶活性[28]。如图3所示,在整个实验期间DHA变化总体可分为3个阶段,即活性下降期、上升期和稳定期。活性上升期和稳定期黑藻组的DHA明显高于对照组,实验后期对照组与黑藻组活性水平都趋向于稳定。这可能是因为黑藻腐解前期好氧微生物快速繁殖,DO迅速被消耗,此时好氧微生物活性受到抑制,微生物群落处于适应期,活性较低。随着黑藻不断腐解,微生物大量繁殖,活性不断上升,至40 d左右达到最高值且趋于稳定。整个实验过程中各组DHA排序为60 g黑藻组>30 g黑藻组>对照组,这可能是因为微生物数量和活性与初期黑藻生物量相关,黑藻腐解能够有效提高沉积物-水界面处的微生物活性,从而影响磷元素在水-底泥-黑藻系统中的迁移转化。
![]() —0 g;
—0 g; ![]() —30 g;
—30 g; ![]() —60 g。
—60 g。
图3 沉积物-水界面脱氢酶活性变化曲线
Figure 3 Curves of dehydrogenase activity at the sediment-water interface
2.4 水-底泥-黑藻系统中磷的迁移转化
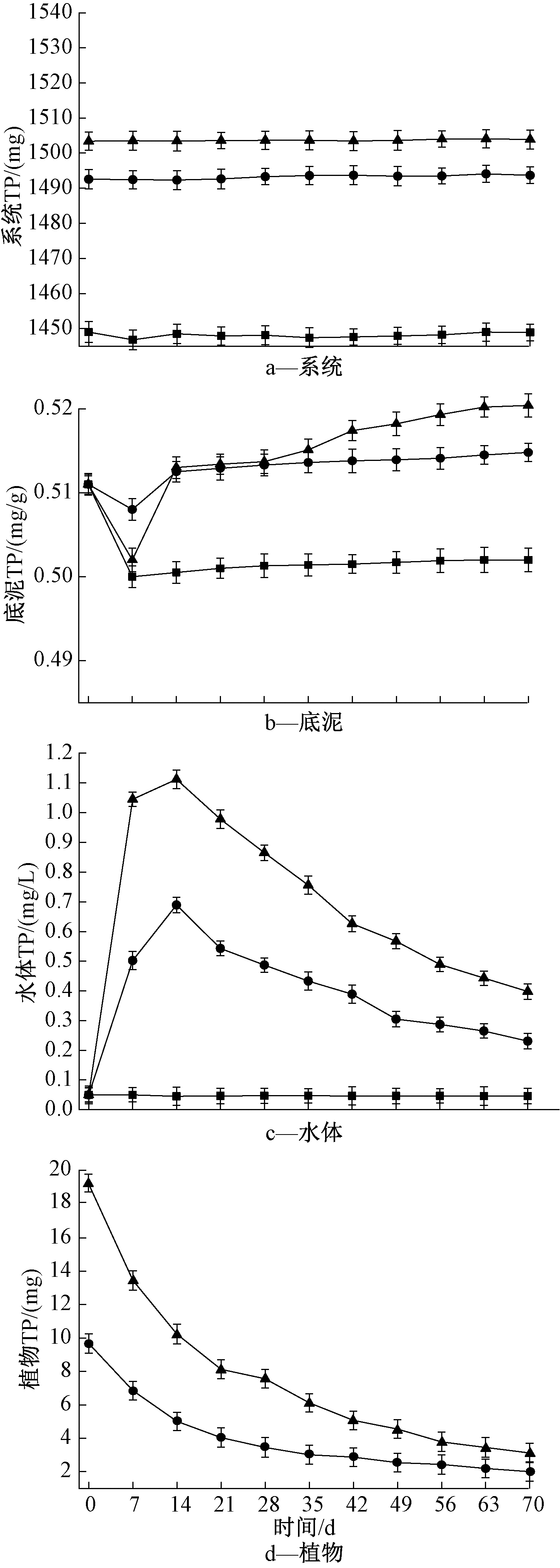
2.4.1 系统及各介质中TP含量的变化
黑藻组系统磷含量由水体、底泥及沉水植物中的磷含量组成,对照组系统磷含量由水体及底泥中的磷含量组成,详见图4。由图4a可知:在实验期间,水-底泥-黑藻系统中TP质量基本守恒。由图4b可知:对照组与黑藻组在实验期间均出现了底泥TP含量先下降再回升的现象。实验期间底泥TP含量排序为对照组<30 g黑藻组<60 g黑藻组。在第70天时,30 g黑藻组底泥中ρ(TP)为0.551 mg/g,较初始时增加了0.044 mg/g;60 g黑藻组底泥中ρ(TP)为0.613 mg/g,较初始时增加了0.106 mg/g。由图4c可知:黑藻组的水体TP含量呈先增后减的趋势,实验初期,黑藻生物量迅速降低(图1),黑藻腐解迅速向水中释放出磷,这说明除了初期底泥向水体释放磷之外,水体中主要磷来源于黑藻的腐解释放。在第14天黑藻组水体TP含量达到最大值,然后随着黑藻腐解过程逐渐减弱,水体TP含量呈下降趋势,这可能是因为随着腐解的进行,水中悬浮的腐解溢散颗粒明显增多,使其水中磷的吸附沉淀作用增强[29]。与底泥中TP含量的不断增加相对应,微生物在碳源充足的情况下迅速繁殖,水中存在大量的磷向底泥迁移,实验后期水体中的磷更多地沉积或者吸附到底泥中[30]。实验结束时,30 g黑藻组水体TP含量较初始时增加了4倍,60 g黑藻组水体TP含量较初始时增加了8.22倍,对照组水体TP含量变化不大。王博等[7]研究表明,黑藻组水体TP含量呈先增后减的趋势,随着黑藻腐解速率的减弱,水体TP含量逐渐下降,这与本研究的发现相符。由图4d可知:黑藻组黑藻的TP含量明显下降,30 g黑藻组与60 g黑藻组黑藻TP含量分别降低了2.25,2.18 mg/g,说明随着黑藻的腐解,黑藻体内的磷不断释放到水体中,会对水体及底泥造成持续污染[31]。
![]() —0 g;
—0 g; ![]() —30 g;
—30 g; ![]() —60 g。
—60 g。
图4 系统及其各介质中TP含量的变化
Figure 4 Changes of total phosphorus content in the system, sediment, water and plant
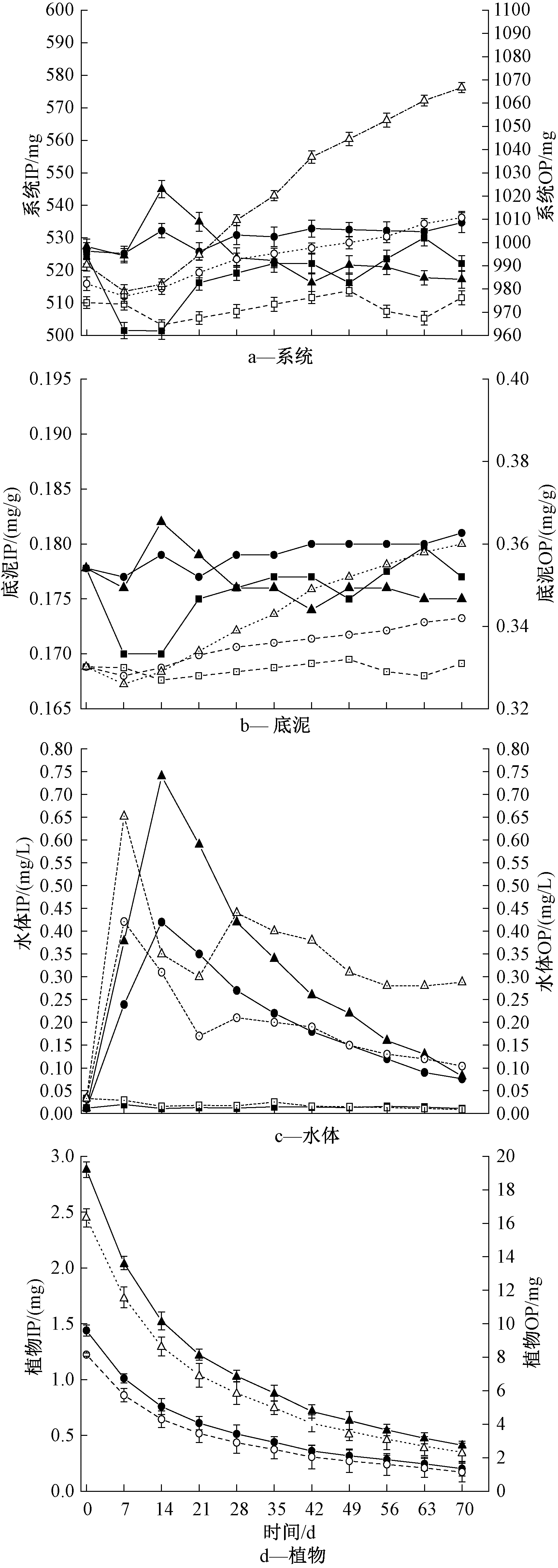
2.4.2 系统及各介质中形态磷含量的变化
系统及各介质中形态磷含量的变化如图5所示。由图5a可知:30 g黑藻组系统中IP和OP含量与初始值相比略有上升,但变化不大;60 g黑藻组系统中IP含量呈先上升后下降趋势,OP呈先降低后上升趋势。由图5b可知:两黑藻组底泥OP含量都呈上升趋势,60 g黑藻组的上升趋势明显>30 g黑藻组。黑藻在腐解过程中向沉积物和水体中释放磷,会受到环境因子如DO、ORP和pH的影响。相关研究报道[32],随着DO含量的降低,水体中IP的含量会上升,说明DO的减少有利于IP从沉积物向间隙水和上覆水中释放。黑藻组底泥IP含量呈先降低后升高的变化趋势,可能是因为实验初期黑藻大量腐解,使得系统中DO含量下降(见图2a);随着黑藻腐解速率减慢,DO含量回升,水体中IP向底泥沉积,使得底泥中IP含量上升。
![]() —0 g-IP;
—0 g-IP; ![]() —30 g-IP;
—30 g-IP; ![]() —60 g-IP;-
—60 g-IP;-![]() --0 g-OP;
--0 g-OP; ![]() …30 g-OP; -
…30 g-OP; -![]() -·60 g-OP。
-·60 g-OP。
图5 系统及其各介质中形态磷含量的变化
Figure 5 Changes of IP and OP content in the system, sediment, water and plant
由图5c可知:水体中黑藻组OP和IP含量呈明显的先增后减趋势,对照组基本维持在初始浓度不变。两黑藻组OP和IP含量的变化与TP含量变化相似,在实验20~40 d水体OP含量的降低比IP略显滞后,这可能是由于黑藻腐解时释放到水体中的OP结构相对稳定,比IP更难以被微生物吸收分解[33]。由图5d可知:黑藻的OP和IP变化与TP(图5d)的变化相似,呈现明显下降趋势。
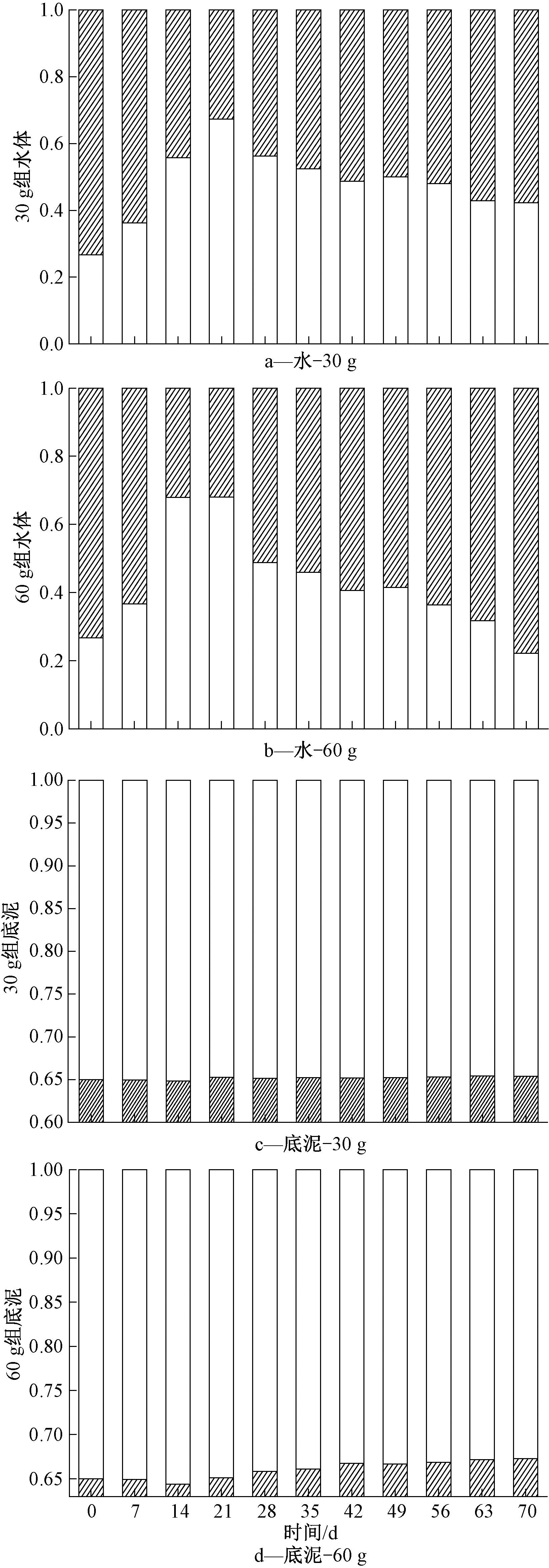
2.4.3 底泥及水体中各形态磷比例的变化
底泥及水体中各形态磷的比例变化如图6所示。由图6a—b可知:水体OP比例呈先下降后上升趋势,水体IP比例呈先上升后下降趋势,且60 g黑藻组趋势变化比30 g黑藻组更加明显,这说明黑藻生物量是导致这一变化的主要原因。实验前期,由于黑藻腐解速率较大,较低的DO含量及OPR可能会导致底泥中Fe3+向Fe2+转化,使被吸附的磷酸盐转变成溶解态而析出,不溶性的[Fe(OH)3]x胶体转化成可溶性的Fe(OH)2,并将吸附的游离态磷释放到水体中[34],从而导致水体中IP的含量增加。随着黑藻腐解速率的减慢,DO含量升高,沉积物对IP的释放作用减弱,所以水体中OP比例呈现先下降后上升趋势。由图6c—d可知:两黑藻组底泥OP含量呈不断上升趋势,且60 g黑藻组比30 g黑藻组上升趋势更明显。
![]() IP;
IP; ![]() OP。
OP。
图6 底泥及水体中各存在形式磷的比例变化
Figure 6 Changes of IP and OP content proportion in the system, sediment, water and plant
3 结 论
1)实验期间内30,60 g黑藻组系统的TP含量分别保持在1493,1503 mg左右,水-沉水植物-底泥系统中TP质量守恒,黑藻腐解具有明显的阶段性,实验初期分解速率明显高于实验中后期,30,60 g黑藻组平均腐解速率分别为0.9754,1.8849 g/d。
2)黑藻的存在明显加强了水-底泥-黑藻系统磷的迁移转化,至实验结束,两黑藻组系统的TP和OP含量较对照组有明显升高,其中OP含量的升高更为明显;两黑藻组底泥TP和OP的含量均比对照组底泥TP和OP的含量增加超过5%。
3)黑藻的腐解改变了系统中磷元素的循环,腐解前期抑制底泥中磷的释放,腐解后期促进磷的释放,并对各形态磷的迁移转化有显著影响。
[1] LIU Y C. Research on the absorption mechanism of submerged macrophytes to phosphorous nutrients in water Body[J]. Journal of Anhui Agricultural Sciences, 2011.
[2] 张晓姣, 朱金格, 刘鑫. 浅水湖泊沉水植物调控技术研究进展[J].净水技术,2018,37(12):46-51.
[3] 毛丽娜, 王国祥, 张利民, 等. 黑藻群丛对水体氮素和其他主要环境因子日变化的影响[J]. 生态与农村环境学报, 2013, 29(6):811-815.
[4] GESSNER M O. Breakdown and nutrient dynamics of submerged Phragmites shoots in the littoral zone of a temperate hard water lake[J]. Aquatie Botany, 2000, 66(1):9-20.
[5] MARION L,PAILLISSON J M. A mass balance assessment of the contribution of floating-leaved macrophytes in nutrient stocks in an eutrophic macrophyte-dominated lake [J]. Aquatic Botany, 2003, 75(3):249-260.
[6] 杨飞, 姚佳, 张毅敏, 等. 温度对沉水植物腐解释放 DOM 及微生物群落多样性的影响[J].中国环境科学,2018,38(10):3904-3913.
[7] 王博,叶春,李春华,等.初春苦草腐解过程中营养盐释放过程及规律 [J].生态与农村环境学报, 2012,28(2):171-175.
[8] 张来甲,叶春,李春华,等.沉水植物腐解对水体水质的影响[J].环境科学研究, 2013,26(2):145-151.
[9] CHEESMANA W, TUIRNER B L, INGLETT P W, et al. Phosphorus transformations during decomposition of wetland macrophytes[J]. Environmental Science & Technology, 2010, 44(24):9265-9271.
[10] 李春华, 叶春, 孔祥臻, 等. 浅水湖泊水生植物适宜生物量评估方法的探讨[J].中国环境科学, 2018, 38(12):4644-4652.
[11] 叶春, 王博, 李春华, 等. 沉水植物黑藻腐解过程中营养盐释放过程[J]. 中国环境科学, 2014, 34(10):2653-2659.
[12] CHRISTOPHER D K C,RUTH L. Revision of the genus Hydrilla(Hydrocharitaceae) [J].Aquatic Botany,1982,13: 485-504.
[13] PIETERSE A H. Hydrilla verticillata a review: abstracts ontropical agriculture[M]. Amsterdam: Royal Tropical Institute,1981,7: 9-34.
[14] 王博,叶春,杨劭.腐解黑藻生物量对高硝态氮水体氮素的影响[J].环境科学研究,2009,22(10): 1198-1203.
[15] YE C,YU H C,KONG H N,et al. Community collocation of four submerged macrophytes on two kinds of sediments in Lake Taihu,China[J].Ecological Engineering,2009,35(11):1656-1663.
[16] 林先贵.土壤微生物研究原理与方法 [M]. 北京:高等教育出版社, 2009:39-60.
[17] 国家环境保护总局, 水和废水监测分析方法编委会.水和废水监测分析方法[M].4版. 北京:中国环境科学出版社, 2002.
[18] 龚莹,王宁,李玉成,等. 巢湖水体-沉积物磷形态与有效性[J]. 生态与农村环境学报, 2015,31(3):359-365.
[19] 尹军, 谭学军, 任南琪, 等.污泥电子传递体系(ETS)活性测定中萃取剂的选择[J].环境科学学报, 2004, 24(3): 413-418.
[20] BLENKINSOPP S A, LOCK M A. The measurement of electron transport system activity in river biofilms [J]. Water Research, 1990, 24(4): 441-445.
[21] JIN Y P, YANG X Y, CHEN G, et al. Improvement of INT-dehydrogenase activity detection method of activated sludge[J]. China Water & Wastewater, 2016. 153-156.
[22] 夏江宝,许景伟,陆兆华,等.黄河三角洲滩地不同植被类型的土壤贮水功能[J].水土保持学报,2009,23(5):79-83.
[23] 党宏忠,周泽福,赵雨森,等.祁连山水源涵养林土壤水文特征研究[J].林业科学研究,2006,19(1):39-44.
[24] WANG Y Y, CHEN F Z. Decomposition and phosphorous release from four different size fractions of Microcystis spp. taken from Lake Taihu, China[J]. Journal of Environmental Sciences,2008,20(7):891-896.
[25] REDDY I D, DANGELO E M. Biogeochemical indicator to evaluate pollutant removal efficiency in constructed wetlands[J]. Water Science and Technology, 1998,35:1-10.
[26] 张荣社, 李广贺, 周琪, 等. 潜流湿地中植物对脱氮除磷效果的影响中试研究[J]. 环境科学, 2005, 26(4): 83-86.
[27] 孙慧卿. 影响湖泊沉积物表层磷行为的关键因素研究[D]. 南京:南京林业大学, 2012.
[28] HERMO G, XI M N,GIRALDEZ L, et al. Relevance of the INT test response as an indicator of ETS activity in monitoring heterotrophic aerobic bacterial populations in activated sludges[J]. Water Research, 1998, 32(4):1213-1221.
[29] 厉恩华, 刘贵华, 李伟. 洪湖三种水生植物的分解速率及氮、磷动态[J].中国环境科学,2006,26(6):667-671.
[30] 汤志凯, 张毅敏, 杨飞, 等. 3 种水生植物腐解过程中磷营养物质迁移、转化过程研究[J].环境科学学报, 2019,39(3):716-721.
[31] 李菲菲, 褚淑祎, 崔灵周, 等. 沉水植物生长和腐解对富营养化水体氮磷的影响机制研究进展[J]. 生态科学, 2018, 37(4): 225-230.
[32] 卢少勇,金相灿,余刚.人工湿地的磷去除机理[J].生态环境, 2006,15(2):391-396.
[33] WANG Z Q, ZHANG S H, ZHE-FENG X U. Forms of phosphorus in sediments from Hongze Lake[J]. Environmental Monitoring & Forewarning, 2011.
[34] ZHOU X, GUO H, ZHANG J, et al. Simulated study on phosphorus release from sediment in Changshou Lake influenced by environmental factors[J]. Chinese Journal of Environmental Engineering, 2013, 7(5):1671-1675.