0 引 言
在石油天然气开采、炼制、化工、冶金等行业生产过程中均会产生大量的含硫废水。含硫废水中的硫化物具有毒性、腐蚀性和臭味,废水中的硫化物还会对生产设备和管道造成较大伤害,因此必须对含硫废水进行处理以达到保护环境的目的[1-3]。目前,国内外处理含硫废水的方法主要有汽提法、氧化法、中和法、真空抽提法、化学沉淀法、化学絮凝法、电化学脱硫法、碱液吸收法和生化法等[4-8]。其中,中和法和生化法适用于处理低浓度含硫废水,汽提法和真空抽提法对设备要求高[9];化学絮凝法操作简单,但在实际操作中沉淀剂用量较大,产生大量污泥,造成二次污染[10];而氧化法特别是化学氧化法具有条件温和、去除率高等特点,不仅能处理高浓度的含硫废水,还能将废水中硫化物氧化为单质硫,从而达到资源回收的目的[10,11]。
Na2SO3是一种常见的亚硫酸盐,易溶于水,分子中的![]() 可与具有强还原性的S2-在反应过程中生成单质硫,有利于单质硫的回收利用。同时,Na2SO3来源广泛,随着SO2烟气治理工程的全面实施,可提供大量廉价的亚硫酸盐。杨德敏等[12]Na2SO3用于处理气田含硫废水,且效果较为显著但并未对单质硫回收率进行考察。
可与具有强还原性的S2-在反应过程中生成单质硫,有利于单质硫的回收利用。同时,Na2SO3来源广泛,随着SO2烟气治理工程的全面实施,可提供大量廉价的亚硫酸盐。杨德敏等[12]Na2SO3用于处理气田含硫废水,且效果较为显著但并未对单质硫回收率进行考察。
本试验以模拟高浓度含硫废水为研究对象,在以Na2SO3作为氧化剂条件下,研究各因素对硫化物去除率和单质硫生成量的影响,并结合Na2SO3氧化脱硫电极电势的理论计算,以及采用反应-离心分离耦合的方法及时分离目标产物单质硫的方式着重研究了Na2SO3氧化硫化物的反应历程,为实现单质硫的资源化回收提供理论参考。
1 试验部分
1.1 仪器及药品
仪器:PHS-3E型数字式显示酸度计、FA2004型上皿电子天平、78-1型磁力加热搅拌器、SHB-Ⅲ型循环水式多用真空泵、TDL-40B型台式离心机、UPC-Ⅲ-40L型优普系列超纯水机。
药品:Na2S·9H2O、Na2S2O3·5H2O、KI、I2、NaOH、可溶性淀粉、盐酸,均为分析纯。
1.2 试验用水及装置
试验用水采用人工配制模拟废水,由Na2S溶于自来水中制成质量浓度为1728 mg/L的Na2S溶液。
试验装置采用组装的氧化脱硫反应装置(图1),主要包括反应器和尾气吸收瓶2个部分。反应在密闭条件下进行,且通过尾气瓶吸收反应过程中产生的H2S气体。
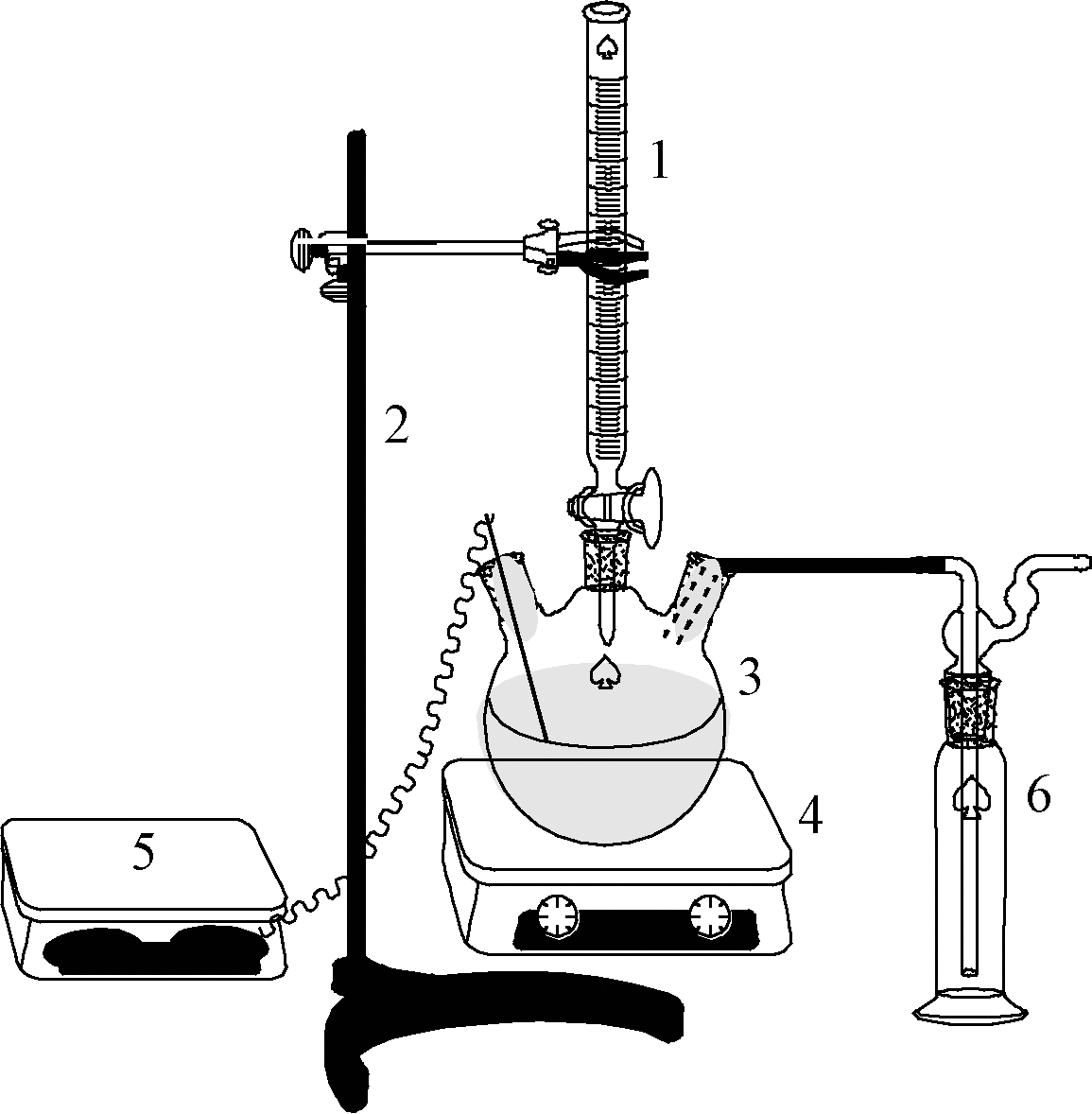
1—酸式滴定管; 2—铁架台; 3—三口圆底烧瓶;4—磁力加热搅拌器; 5—pH计; 6—尾气吸收瓶。
图1 氧化脱硫反应装置
Figure 1 Experiment device of oxidative desulfurization
1.3 试验方法
试验前对玻璃仪器进行反复清洗并烘干冷却备用,将200 mL含硫废水和搅拌器转子倒入三口烧瓶中并连接好装置,向废水中加入一定质量浓度的Na2SO3溶液,通过酸式滴定管加酸调节废水初始pH,并快速启动搅拌器,反应结束后对氧化产物进行测定。采用离心机及时分离单质硫,实验时首先将50 mL废水加入100 mL离心管中,加入一定量Na2SO3后调节废水初始pH值进行离心反应,反应结束后对氧化产物进行测定。
1.4 分析方法
采用碘量法(HJ/T 60—2000)对废水中S2-含量进行测定;![]() 采用滴定法测定;固相产物晶体结构采用X’Pert Pro MPD型X射线衍射仪分析。
采用滴定法测定;固相产物晶体结构采用X’Pert Pro MPD型X射线衍射仪分析。
硫化物去除率具体计算方法如式(1)所示:
η1=(c0-ci)/c0×100%
(1)
式中:c0为原水中硫离子浓度,mg/L;ci为反应结束后体系剩余硫离子浓度,mg/L。
在非标准状态下,用电极电势的能斯特方程能更准确地体现氧化还原电对的实际氧化还原能力,能斯特方程计算公式[13]如式(2)所示:
En=E0+(RT/nF)ln[c(Ox)a/c(Red)b]
(2)
式中:E0为标准氧化还原电位,V;R为气体常数,R=8.314 J/(K·mol);T为绝对温度,K;F为法拉第常数,为96485 J/(mol·V);n为参与反应的电子数;c(Ox)为氧化态物质浓度,mg/L;a为氧化态物质在电极反应中的系数;c(Red)为还原态物质浓度,mg/L;b为还原态物质在电极反应中的系数。
能斯特方程式的计算依赖已知的标准电极电势,而未知电对的标准电极电势则可以利用元素电势图和相邻电对的已知标准电极电势计算得到,计算如式(3)[13]所示:
![]()
(3)
式中:n1、n2分别为各电对的转移电子数;![]() 和
和![]() 分别为某未知电对两个相邻电对的已知标准电极电势,
分别为某未知电对两个相邻电对的已知标准电极电势,![]() 为某未知电对的标准电极电势,V。
为某未知电对的标准电极电势,V。
2 结果与讨论
2.1 初始pH对硫化物去除效果的影响
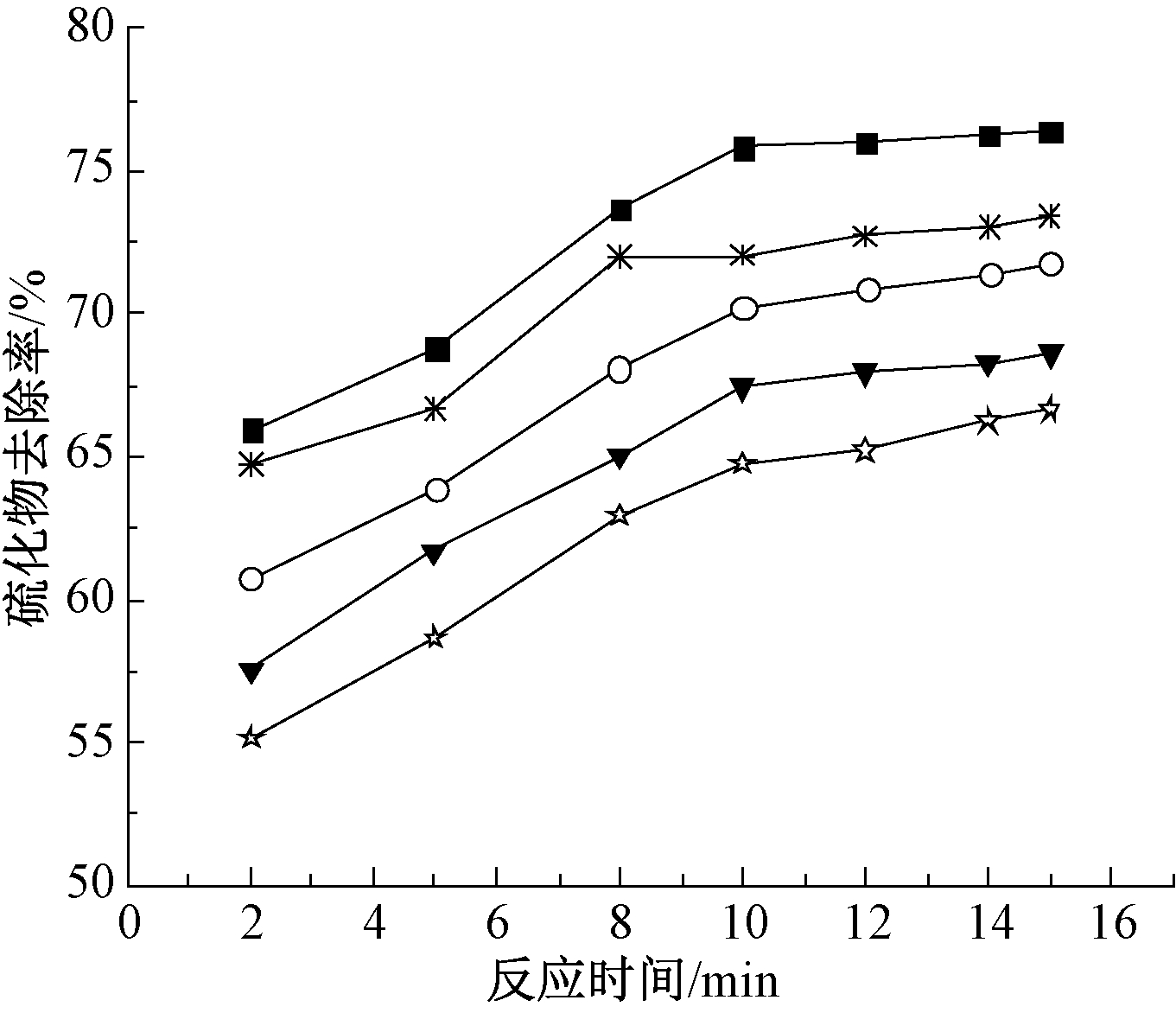
以Na2SO3为氧化剂(初始ρ(Na2SO3)=5 g/L),在不同pH条件下,硫化物去除率随时间变化如图2所示。
![]() —pH=3;
—pH=3; ![]() —pH=4;
—pH=4; ![]() —pH=5;
—pH=5; ![]() —pH=6;
—pH=6; ![]() —pH=7。
—pH=7。
图2 初始pH对硫化物去除率的影响
Figure 2 Effect of initial pH on sulfide removal efficiency
由图2可知:在不同pH条件下,硫化物去除率均随着反应时间的延长而逐渐提高,且反应10 min之前去除率提高较快,10 min之后基本趋于稳定。以单质硫S0为目标产物,Na2SO3氧化硫化物过程的反应式主要为:
![]()
(4)
![]()
(5)
![]()
(6)
反应前10 min硫化物去除较快,主要是因为在10 min内,H2S和![]() 浓度较大,2种反应组分充分混合,反应迅速发生。10 min之后,随着反应的进行,反应体系中的氧化剂
浓度较大,2种反应组分充分混合,反应迅速发生。10 min之后,随着反应的进行,反应体系中的氧化剂![]() 不断被消耗,导致反应式(4)—(5)的反应速率逐渐下降。在相同反应时间下,硫化物去除率随着初始pH值的升高而逐渐下降,当pH由3升高至7时,反应15 min后硫化物去除率由76.41%降低到66.65%,这主要是因为Na2SO3的氧化性由
不断被消耗,导致反应式(4)—(5)的反应速率逐渐下降。在相同反应时间下,硫化物去除率随着初始pH值的升高而逐渐下降,当pH由3升高至7时,反应15 min后硫化物去除率由76.41%降低到66.65%,这主要是因为Na2SO3的氧化性由![]() 体现,而
体现,而![]() 属于含氧酸盐,其氧化能力会随着酸度下降而下降[13],同时由反应式(4)—(5)可知,Na2SO3氧化硫化物的反应需要在有一定H+存在的条件下进行,因此酸性条件下硫化物去除效果较好。另外,当废水pH<5时,体系中绝大部分硫化物以H2S的形式存在,由于H2S在水中溶解度低,酸性越强则会有越多的H2S气体溢出,从而降低体系中硫化物的浓度。因此综合考虑,控制反应体系pH为5,硫化物去除率为71.79%,在保证硫化物去除率的前提下尽可能多地将硫化物氧化。
属于含氧酸盐,其氧化能力会随着酸度下降而下降[13],同时由反应式(4)—(5)可知,Na2SO3氧化硫化物的反应需要在有一定H+存在的条件下进行,因此酸性条件下硫化物去除效果较好。另外,当废水pH<5时,体系中绝大部分硫化物以H2S的形式存在,由于H2S在水中溶解度低,酸性越强则会有越多的H2S气体溢出,从而降低体系中硫化物的浓度。因此综合考虑,控制反应体系pH为5,硫化物去除率为71.79%,在保证硫化物去除率的前提下尽可能多地将硫化物氧化。
2.2 氧化剂投加量对氧化产物的影响
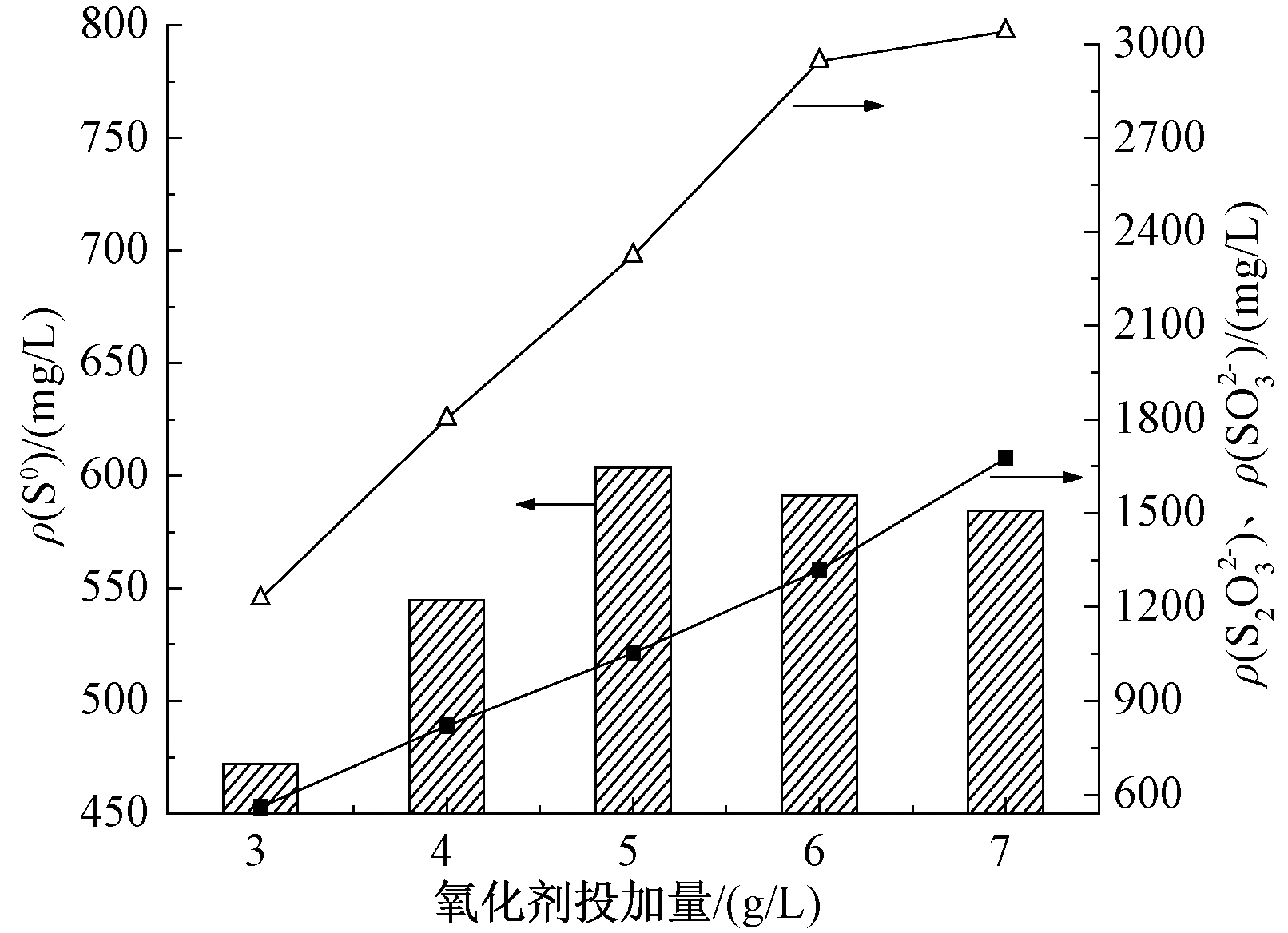
在反应体系pH=5的条件下,氧化剂投加量对氧化产物的影响如图3所示。
![]()
![]()
图3 氧化剂投加量对氧化产物的影响
Figure 3 Effect of oxidants addition on oxidation products
由图3可知:Na2SO3氧化硫化物的主要产物为![]() 和
和![]() 种产物生成量均随着氧化剂投加量增加而增大,同时,氧化过程中也有一定量的S0生成,且随氧化剂投加量的增加先增多后减少,在投加量为5 g/L时达到最大值603.5 mg/L。这一变化趋势与其他2种产物的变化趋势有所区别,主要是因为反应生成的S0相对不稳定,很容易被继续氧化为相对稳定的高价态硫氧酸盐,同时当反应体系氧化剂过剩时也会促进副反应式(6)的发生,此反应在消耗氧化剂的同时也会消耗S0,并使
种产物生成量均随着氧化剂投加量增加而增大,同时,氧化过程中也有一定量的S0生成,且随氧化剂投加量的增加先增多后减少,在投加量为5 g/L时达到最大值603.5 mg/L。这一变化趋势与其他2种产物的变化趋势有所区别,主要是因为反应生成的S0相对不稳定,很容易被继续氧化为相对稳定的高价态硫氧酸盐,同时当反应体系氧化剂过剩时也会促进副反应式(6)的发生,此反应在消耗氧化剂的同时也会消耗S0,并使![]() 产量有所增加。
产量有所增加。
由图2—3可知,Na2SO3氧化脱硫的最佳反应条件为:初始pH为5,反应时间为15 min,氧化剂投加量为5 g/L,此条件下硫化物去除率为71.79%,S0生成量为603.5 mg/L。
2.3 Na2SO3氧化脱硫的理论电极电势
在Na2SO3氧化硫化物过程中,已知物质在酸性介质中标准电极电势如表1所示。
表1 已知物质在酸性介质中标准电极电势
Table 1 Standard electrode potentials of the known substances in acidic media
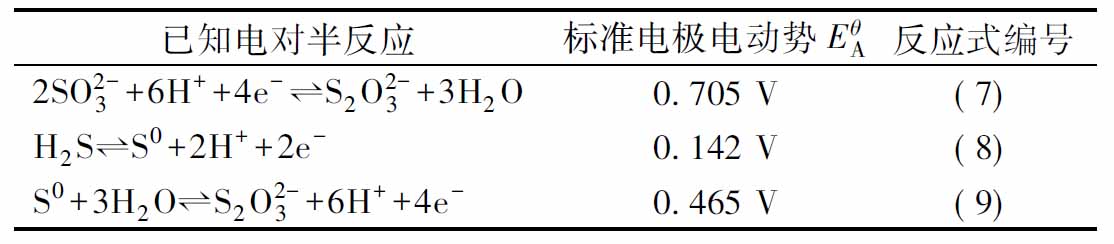
已知电对半反应标准电极电动势EθA反应式编号2SO2-3+6H++4e-⇌S2O2-3+3H2O0.705V(7)H2S⇌S0+2H++2e-0.142V(8)S0+3H2O⇌S2O2-3+6H++4e-0.465V(9)
未知电对标准电极电势计算结果如表2所示。
表2 未知电对的标准电极电势
Table 2 Standard electrode potential of the unknown pairs

未知电对标准电极电势EθA反应式编号SO2-3/S00.585V(10)S2O2-3/H2S0.304V(11)
根据计算,不同温度和pH条件下的电极电势如图4a所示,不同氧化剂投加量和pH条件下(t=25 ℃)的电极电势如图4b所示,不同产物离子浓度下(t=25 ℃、pH=5、ρ(Na2SO3)=5 g/L)的电极电势如图4c所示。
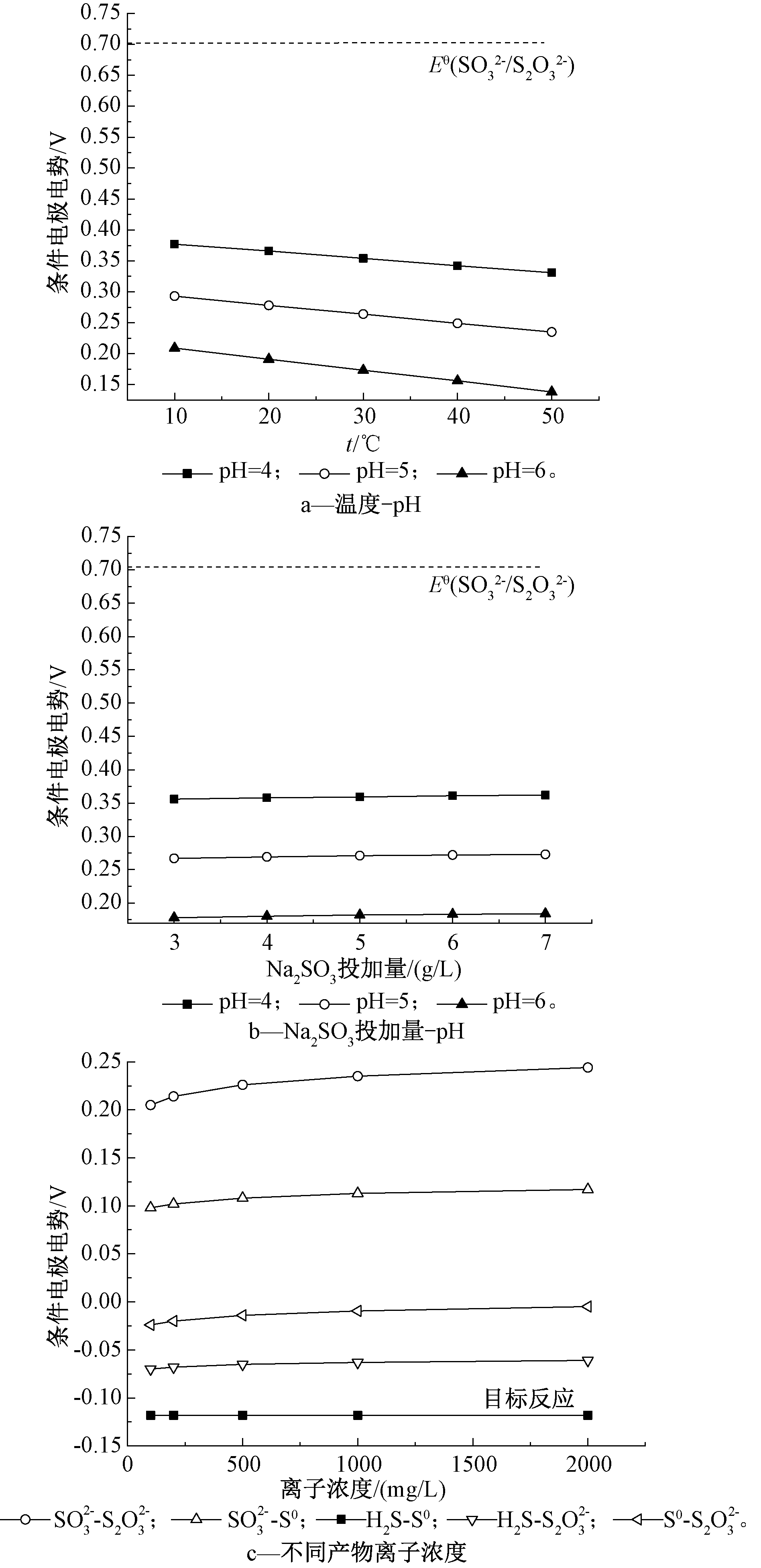
图4 不同条件下各电对的电极电势
Figure 4 Electrode potential of each pair under different conditions
由图4a—b可知:在非标准状态下,氧化剂电对![]() 的电极电势随温度的增大而减小,随氧化剂投加量的增大而缓慢增大,随pH的增大而减小,且减小趋势明显大于电极电势随温度变化的趋势,而温度变化趋势又大于随氧化剂投加量变化的趋势,这表明在非标准状态下,影响氧化剂本身的氧化能力的因素主要为体系pH。由pH变化趋势可知,氧化剂氧化能力随pH增大而逐渐减小,这即是Na2SO3的氧化性随pH升高而逐渐减弱的原因。综合考虑硫化物去除效果和被转化为S0的效果,选择pH=5为Na2SO3氧化硫化物的最佳条件。在此条件下,计算绘得还原剂电极电势随产物离子浓度变化的曲线图,如图4c所示。
的电极电势随温度的增大而减小,随氧化剂投加量的增大而缓慢增大,随pH的增大而减小,且减小趋势明显大于电极电势随温度变化的趋势,而温度变化趋势又大于随氧化剂投加量变化的趋势,这表明在非标准状态下,影响氧化剂本身的氧化能力的因素主要为体系pH。由pH变化趋势可知,氧化剂氧化能力随pH增大而逐渐减小,这即是Na2SO3的氧化性随pH升高而逐渐减弱的原因。综合考虑硫化物去除效果和被转化为S0的效果,选择pH=5为Na2SO3氧化硫化物的最佳条件。在此条件下,计算绘得还原剂电极电势随产物离子浓度变化的曲线图,如图4c所示。
为了实现硫的资源化,将H2S被氧化为S0的反应作为目标反应。由图4c可知:各还原剂电对的电势均随产物离子浓度的增大而增大,且均![]() 说明各氧化反应理论上均能发生,且反应趋势随着氧化产物的生成而逐渐减小。从氧化反应推动力来看,目标产物S0应该为主要产物,而实际产物却为
说明各氧化反应理论上均能发生,且反应趋势随着氧化产物的生成而逐渐减小。从氧化反应推动力来看,目标产物S0应该为主要产物,而实际产物却为![]() 和
和![]() 相对较少,这主要是因为氧化产物不仅与氧化还原电势有关,还与硫元素价态转化规律有关。在氧化还原反应中,处于某一中间价态的硫化合价降低或升高时,一般先直接降低或升高到相邻的价态,即邻位转化规律,同时,当高价态硫与低价态硫直接发生氧化反应时,还应遵循不相交规律,即高价态硫还原后的价态不低于低价态硫氧化后的价态[14]。综合该价态转化规律以及实际产物浓度可知,Na2SO3氧化硫化物时主要被还原成
相对较少,这主要是因为氧化产物不仅与氧化还原电势有关,还与硫元素价态转化规律有关。在氧化还原反应中,处于某一中间价态的硫化合价降低或升高时,一般先直接降低或升高到相邻的价态,即邻位转化规律,同时,当高价态硫与低价态硫直接发生氧化反应时,还应遵循不相交规律,即高价态硫还原后的价态不低于低价态硫氧化后的价态[14]。综合该价态转化规律以及实际产物浓度可知,Na2SO3氧化硫化物时主要被还原成![]() 而硫化物首先被氧化为S0,由于氧化剂本身以
而硫化物首先被氧化为S0,由于氧化剂本身以![]() 存在,S0和
存在,S0和![]() 还会继续发生归中反应,如式(6)所示,因此S0被继续氧化成
还会继续发生归中反应,如式(6)所示,因此S0被继续氧化成![]() 由于Na2SO3氧化性较弱,由图4c可看出:各氧化反应推动力也相对较小,在强氧化剂不存在的条件下,
由于Na2SO3氧化性较弱,由图4c可看出:各氧化反应推动力也相对较小,在强氧化剂不存在的条件下,![]() 不会被继续氧化为SO42-,而
不会被继续氧化为SO42-,而![]() 的存在是由氧化剂本身引入的,因此Na2SO3氧化硫化物主要产物为
的存在是由氧化剂本身引入的,因此Na2SO3氧化硫化物主要产物为![]() 和
和![]()
2.4 Na2SO3氧化硫化物反应历程分析
为了进一步研究Na2SO3氧化硫化物的氧化历程,采用反应-离心分离耦合的方法及时分离目标产物S0,考察其对氧化产物分布的影响。在最佳反应条件下,氧化产物随离心转速的变化如图5所示。
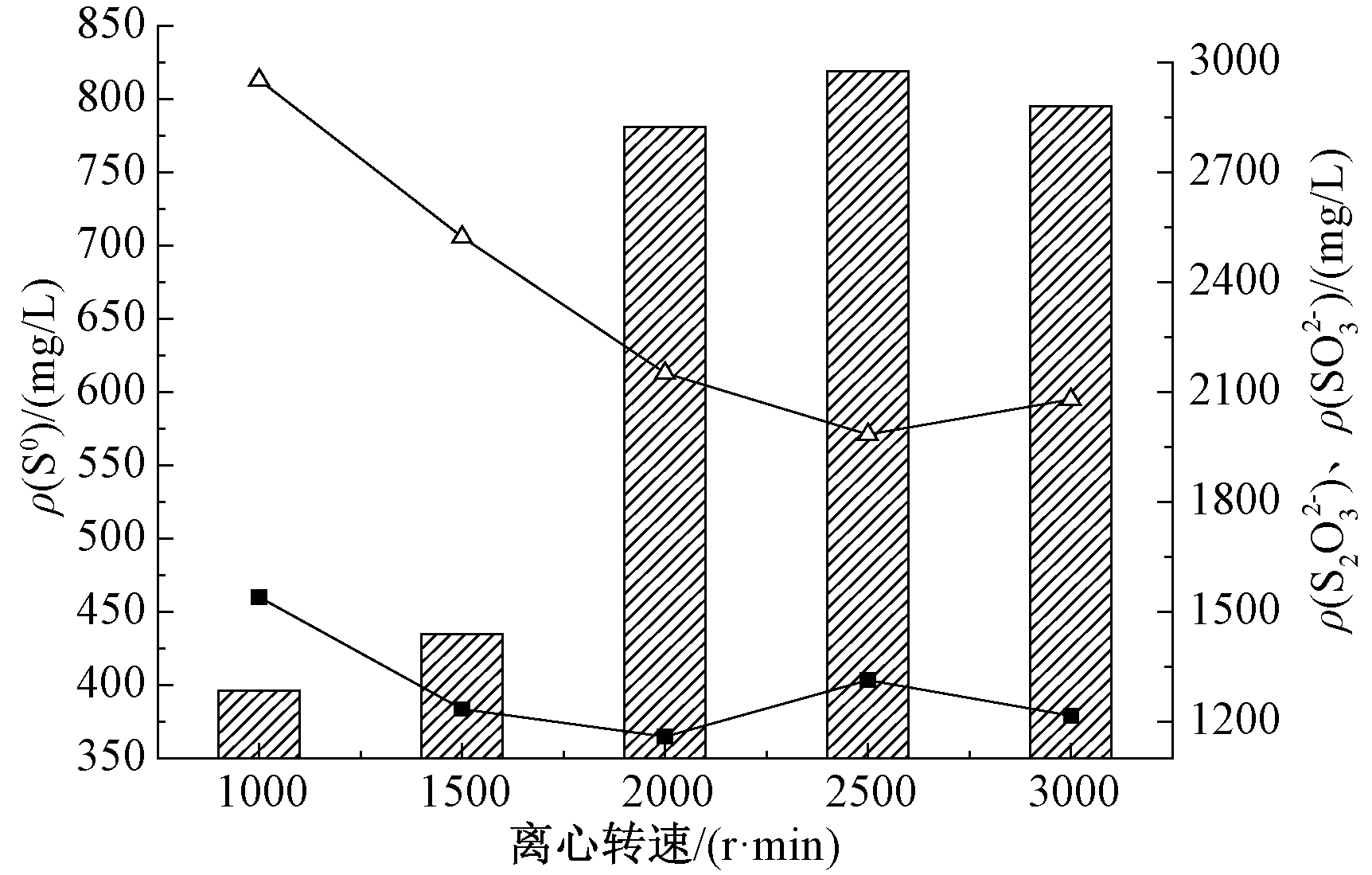
![]()
![]()
图5 不同离心转速下氧化产物分布
Figure 5 Distribution of oxidation products at different centrifugal speeds
由图5可知:在离心反应强化单质硫转化过程中,Na2SO3氧化含硫废水主要产物仍然是![]() 和
和![]() 产量随离心转速增大而呈现先迅速下降再缓慢上升的趋势,在2500 r/min时产量最小,为
产量随离心转速增大而呈现先迅速下降再缓慢上升的趋势,在2500 r/min时产量最小,为![]() 产量先随离心转速增大而减少,在2000 r/min时产量降低到1158.4 mg/L,随后产量随转速增大呈波动趋势。目标产物S0在离心转速≤1500 r/min时产量较少,且少于普通反应体系[11];当转速达到2000 r/min以上时,S0产量明显增多,且在2500 r/min时达到最大值819.5 mg/L,之后继续增大转速,3000 r/min时S0产量略有降低,这可能是因为在较大转速条件下分离目标产物S0的同时,也使各种反应物在体系中处于均匀分散,充分接触的状态,增大了反应物分子间碰撞的概率,同时促进了主反应和副反应的发生,造成此时S0产量相较于2500 r/min时略有波动。由此可知,离心反应强化体系中,转速为2500 r/min时S0产量最高,在此条件下与普通反应体系中各氧化产物占比对比如图6所示。
产量先随离心转速增大而减少,在2000 r/min时产量降低到1158.4 mg/L,随后产量随转速增大呈波动趋势。目标产物S0在离心转速≤1500 r/min时产量较少,且少于普通反应体系[11];当转速达到2000 r/min以上时,S0产量明显增多,且在2500 r/min时达到最大值819.5 mg/L,之后继续增大转速,3000 r/min时S0产量略有降低,这可能是因为在较大转速条件下分离目标产物S0的同时,也使各种反应物在体系中处于均匀分散,充分接触的状态,增大了反应物分子间碰撞的概率,同时促进了主反应和副反应的发生,造成此时S0产量相较于2500 r/min时略有波动。由此可知,离心反应强化体系中,转速为2500 r/min时S0产量最高,在此条件下与普通反应体系中各氧化产物占比对比如图6所示。
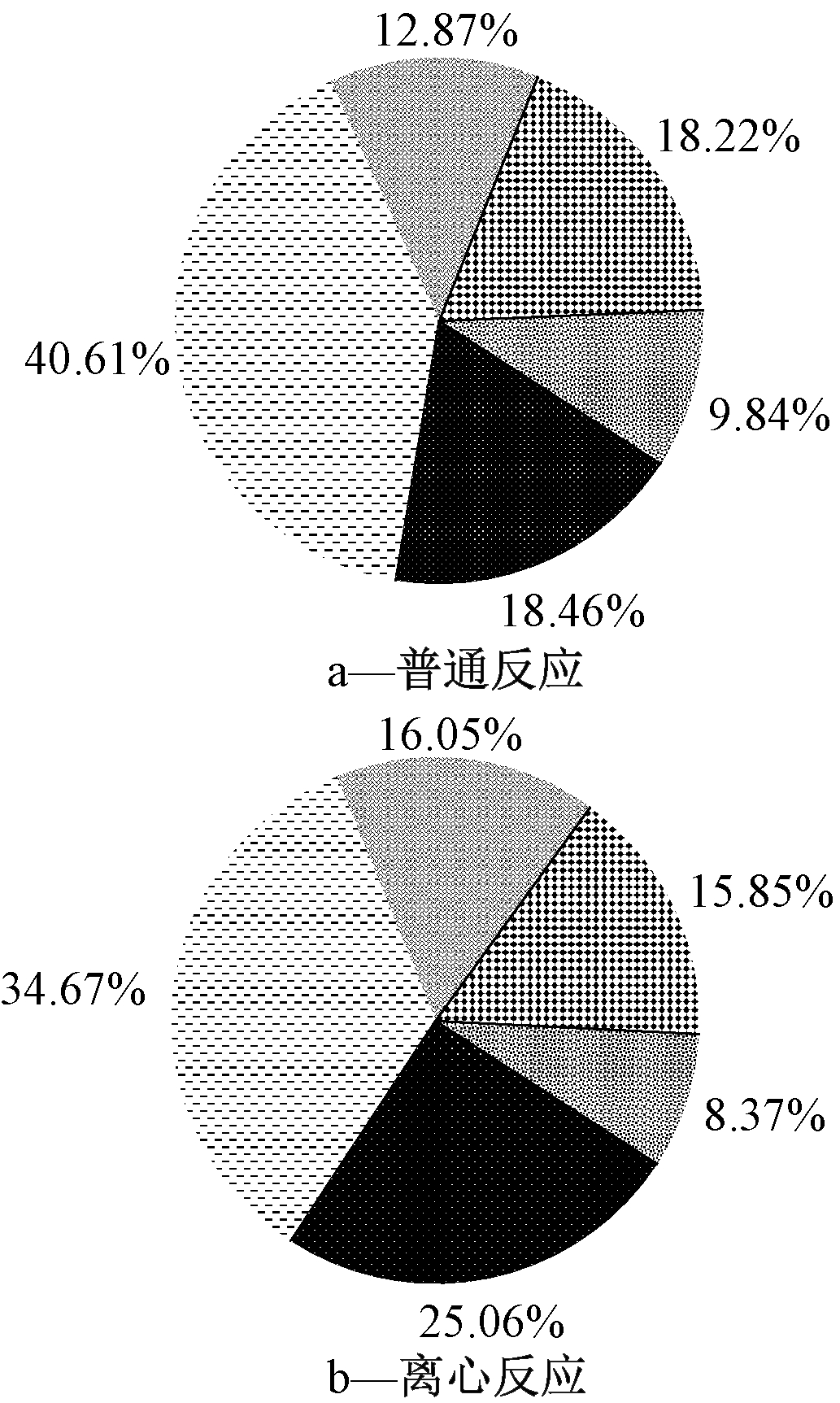
![]() S0;
S0; ![]()
![]()
![]()
![]()
![]() S2-;
S2-; ![]() 其他。
其他。
图6 2种反应体系中氧化产物占比
Figure 6 Oxidation products’ proportion of two reaction systems
由图6可知:离心反应降低了体系中硫化物浓度和产物![]() 浓度,同时提高了
浓度,同时提高了![]() 浓度,并将S0转化率由18.46%提高到25.06%。这主要是因为在离心反应强化体系中,反应过程中产生的S0在较高转速的离心力作用下会被分离出反应体系,这在一定程度上既减少了S0与氧化剂接触的机会,减少了S0的消耗,又促进了目标反应(4)向正反应方向进行,从而提高了硫化物去除率和S0产量。另外,随着中间产物S0被分离,副反应(6)由于缺乏反应物而受到抑制,从而导致了产物
浓度,并将S0转化率由18.46%提高到25.06%。这主要是因为在离心反应强化体系中,反应过程中产生的S0在较高转速的离心力作用下会被分离出反应体系,这在一定程度上既减少了S0与氧化剂接触的机会,减少了S0的消耗,又促进了目标反应(4)向正反应方向进行,从而提高了硫化物去除率和S0产量。另外,随着中间产物S0被分离,副反应(6)由于缺乏反应物而受到抑制,从而导致了产物![]() 产量减少,而
产量减少,而![]() 浓度上升。在低转速的反应条件下无法达到理想效果,可能是因为低转速时产生的离心力较小,同时反应最初形成的S0颗粒细小,因此低转速条件下不足以使反应过程中生成的S0被分离出反应体系,S0在反应体系中继续与
浓度上升。在低转速的反应条件下无法达到理想效果,可能是因为低转速时产生的离心力较小,同时反应最初形成的S0颗粒细小,因此低转速条件下不足以使反应过程中生成的S0被分离出反应体系,S0在反应体系中继续与![]() 发生副反应,生成副产物
发生副反应,生成副产物![]() 造成低转速条件下S0产量较低。
造成低转速条件下S0产量较低。
结合实际氧化产物分布情况、电极电势的理论计算和及时分离目标产物对氧化产物分布的影响情况,推测在Na2SO3氧化硫化物的过程中,硫化物被氧化为S0,此反应为目标反应,同时![]() 被还原为
被还原为![]() 当反应体系同时存在S0和
当反应体系同时存在S0和![]() 时,两者会发生归中反应生成
时,两者会发生归中反应生成![]() 由式(6)可知,此副反应为双分子反应,而目标反应(4)则是三分子反应,由于反应一定要有相关分子或离子相互碰撞后才能发生,而三分子反应在空间某点上碰撞的概率要比双分子反应小得多[13],体系中副反应氧化速率明显快于目标反应,因此该副反应为体系主要反应,
由式(6)可知,此副反应为双分子反应,而目标反应(4)则是三分子反应,由于反应一定要有相关分子或离子相互碰撞后才能发生,而三分子反应在空间某点上碰撞的概率要比双分子反应小得多[13],体系中副反应氧化速率明显快于目标反应,因此该副反应为体系主要反应,![]() 为主要氧化产物。
为主要氧化产物。
2.5 固相产物成分分析
普通反应体系和离心反应强化体系所得固相产物为淡黄色固体,比普通硫黄更容易研磨成较细的粉末,且研磨后的粉末固体分散性较好。对2种固相产物成分和晶形进行考察,将其进行XRD分析,X射线衍射图谱如图7所示。
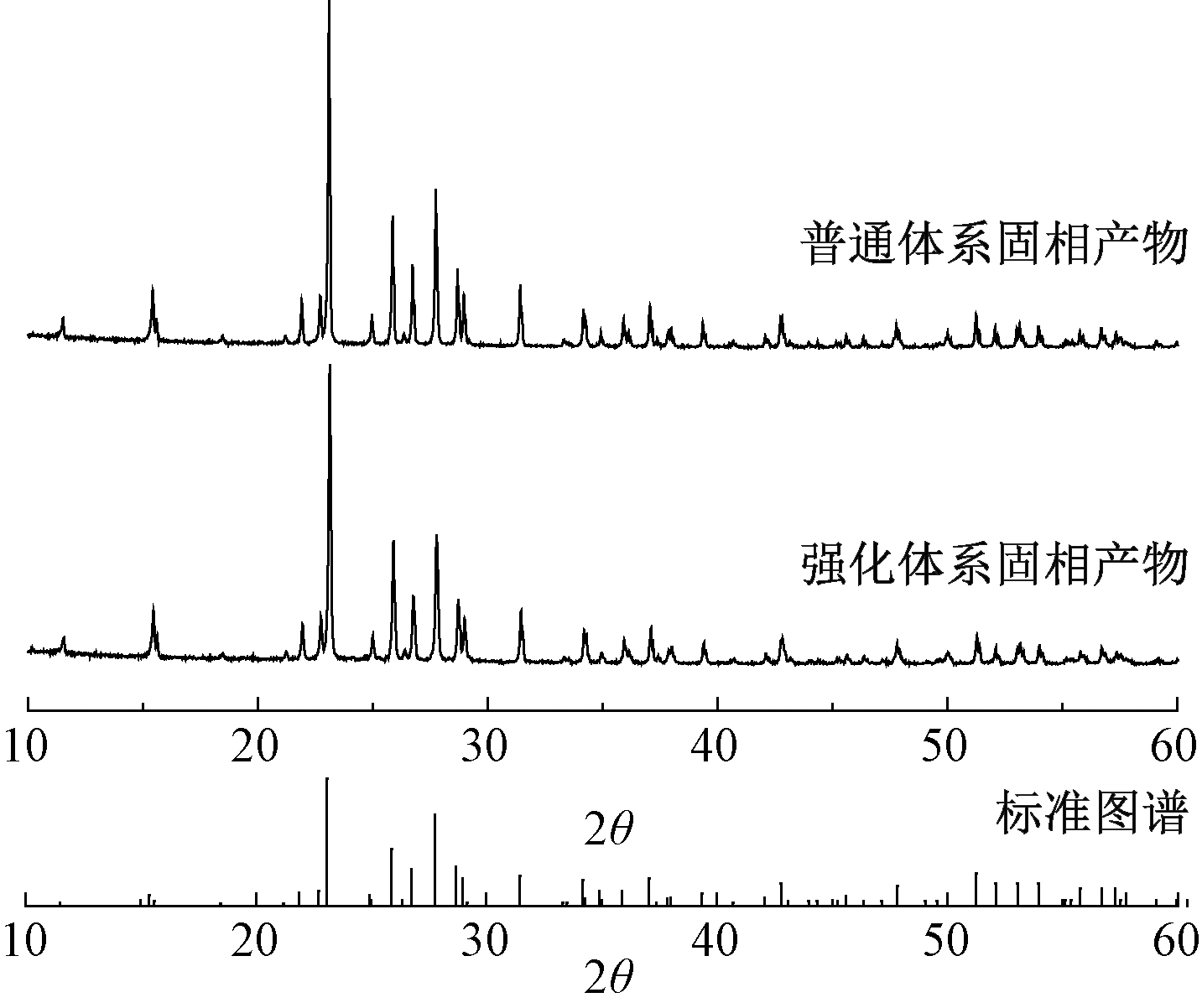
图7 固相产物的X射线衍射图
Figure 7 X-ray diffraction diagram of the solid phase products
由图7可知:2种反应体系固相产物的X射线衍射图谱的出峰位置相同,且与S0标准卡PDF#08-0247图谱基本一致,图中强度较大的衍射峰分别在2θ为23.082°、25.879°、26.749°和27.769°处出现,分别对应S的(222)、(026)、(311)、(040)晶面族,这表明2种体系的固相产物均是S0,且在内部结构上与普通硫黄基本保持一致,纯度较高。由此可知:经过反应-离心分离耦合的强化反应体系后所形成的S0成分和晶形结构与普通体系相比并未发生改变。由于S—S键合时能形成多种不同形式的分子,而这些分子又能以各种方式排列成晶体,因此硫元素具有多种同素异形体Sn(如S2、S4、S6、S8和S10等),而Sn主要存在形式为硫环和链状硫[15]。在硫的环状分子中最稳定常见的为环八硫S8,S8由于在晶格中排列方式不同,又可形成3种同素异形体:斜方硫(α-硫)、β-单斜硫和γ-单斜硫,其中只有斜方硫(α-硫)才能在96 ℃以下稳定存在,是热力学最稳定的晶体硫[15]。环八硫S8的正交晶系参数有1046.5,1286.6,2448.6 pm 3类,其空间群形式为Fddd[16]。因此,由2种反应体系固相产物的XRD分析结果可知,Na2SO3氧化硫化物过程中,普通反应体系和离心反应强化体系产生的固相产物均主要为S8环状分子,正交晶系斜方硫。
3 结 论
1)采用Na2SO3氧化含硫废水,在ρ(Na2SO3)=5 g/L、不同pH条件下,硫化物去除率随体系pH的升高而逐渐下降,当pH由3升高至7时,反应15 min后硫化物去除率由76.41%降低到66.65%,酸性条件更有利于脱硫反应的进行。
2)采用Na2SO3氧化含硫废水,在反应体系pH=5的条件下,主要氧化产物为![]() 和
和![]() 种产物生成量均随氧化剂投加量的增加而增大,同时,氧化过程中有少量S0生成,且随氧化剂投加量的增加先增多后减少,在投加量为5 g/L时达到最大值603.5 mg/L。
种产物生成量均随氧化剂投加量的增加而增大,同时,氧化过程中有少量S0生成,且随氧化剂投加量的增加先增多后减少,在投加量为5 g/L时达到最大值603.5 mg/L。
3)根据Na2SO3氧化脱硫电极电势的理论计算可知,在非标准状态下,影响Na2SO3本身的氧化能力的主要因素为体系pH值。
4)采用反应-离心分离耦合强化S0分离效果有利于提高硫化物去除率和S0转化率,并降低![]() 转化率;结合Na2SO3氧化脱硫电极电势的理论计算可知,Na2SO3氧化硫化物的过程,主要是先将其氧化为S0,自身被还原为
转化率;结合Na2SO3氧化脱硫电极电势的理论计算可知,Na2SO3氧化硫化物的过程,主要是先将其氧化为S0,自身被还原为![]() 同时生成的S0与
同时生成的S0与![]() 发生归中反应生成
发生归中反应生成![]()
5)通过XRD对普通反应体系和离心反应强化体系所得的固相产物进行分析对比,2种体系中所得的固相产物均为S0,且以结构稳定的S8,正交晶系斜方硫为主。
[1] 闫玉乐, 王凤伟, 周博涵, 等. 油气田含硫污水处理技术[J]. 广东化工, 2017, 44(19): 108-110,105.
[2] RUDIGER R, MARTIN P, INGO S, et al. Colonisation of toxic environments drives predictable life-history evolution in live bearing fishes (Poeciliidae) [J]. Ecology Letters, 2014, 17(1): 65-71.
[3] 刘春霞, 马兴, 魏国华, 等. 一种新型“Turn-on”荧光探针用于硫化氢可视化检测[J]. 环境科学, 2015, 36(1):343-348.
[4] 刘继, 何江, 金培玉, 等. 高浓度含硫废盐水处理工艺的研究[J]. 有机硅材料, 2019, 33 (1): 50-53.
[5] 王旭波, 纪振, 吕文明, 等. 物化预处理-UASB-SBR工艺处理化工中间体废水[J]. 工业水处理, 2018, 38(1):93-95.
[6] HARIZ I B, HALLEB A, ADHOUM N, et al. Treatment of petroleum refinery sulfidic spent caustic wastes by electrocoagulation [J]. Separation & Purification Technology, 2013, 107(4): 150-157.
[7] 谢鹏波, 徐志达. 广州石化延迟焦化含硫污水的处理技术探讨[J]. 炼油技术与工程, 2017, 47(7):54-57.
[8] 郭云红, 叶正芳, 赵泉林. 絮凝沉淀-固定化微生物组合工艺处理炼油厂含硫废水和催化剂废水[J]. 环境工程学报, 2016,10(2):749-754.
[9] 曲虎. 气提法去除油田污水中腐蚀性气体的实验研究[D]. 青岛:中国石油大学(华东), 2012.
[10] 郭二亮, 崔雯谣, 吴迪, 等. MnO2/γ-Al2O3的制备及催化空气氧化处理制革含硫废水[J]. 中国皮革, 2019, 48(2):36-42.
[11] 林奇. 含硫废水中硫的受控氧化过程研究[D]. 成都:西南石油大学, 2014.
[12] 杨德敏, 袁建梅, 谢崇文, 等. 气田高浓度含硫废水的化学氧化处理[J]. 环境工程学报, 2014,8(11):4757-4760.
[13] 贾之慎. 无机及分析化学[M]. 2版. 北京: 高等教育出版社, 2014.
[14] 周艳辉. 关于硫元素价态转化的总结[J]. 河北理科教学研究, 2007(3):67-68.
[15] 张仿刚, 徐宾. 硫及其化合物的分子结构分析[J]. 化学教育, 2014, (9):84-87.
[16] 王丹. 高含硫废水受控氧化及单质硫的形成特性研究[D]. 成都:西南石油大学, 2015.