0 引 言
城市污水厂二级出水经过再生处理,回灌储存于地下含水层中,是全球倍受关注的污水资源化新途径,兼具减少污染负荷排放、涵养地下水系统等多重意义[1,2],尤其是在干旱缺水的城市地区(如美国西部、澳大利亚及中国北方),管理集中、水量稳定的二级出水常常是回灌水源的“天然唯一”选择。但二级出水中含有大量溶解性有机物(dissolved organic matter, DOM),包含天然溶解有机物、溶解性微生物代谢产物等多类组分,即便经过混凝、沉淀、过滤等深度处理,仍可能有大量残余,是影响回用水质安全的关键[3]。这些残余DOM的介入既能通过提高需氧量或有机碳含量等指标降低受纳水体的品质,其本身也可能具有毒害性或成为后续衍生毒性物质的前体物;另外,DOM的组成复杂,由不同结构和分子量大小的有机化合物组成,包含羟基、羧基、羰基等多种活性官能团,因此能通过范德华力、氢键作用、离子交换、氧化还原等干预其他共存污染物的环境行为[4,5]。
在再生水经由包气带向下回灌渗滤的体系中,渗流路径上土壤介质、土壤DOM与再生水DOM之间发生对流弥散、吸附沉积、淋滤释放等一系列反应,受不同源DOM性质差异的影响,水岩交互作用下回灌水与淋出水在DOM含量与组成方面可能发生改变[6]。传统的地下水人工回灌研究聚焦于无机水文地球化学变化或采用总量指标(TOC、COD、BOD等)分析有机物的截留衰减,对DOM组成结构演变,特别是其中穿透包气带进入含水层的主要成分特性认识不足。基于此,本研究依托野外包气带介质和实际再生水开展回灌渗滤过程模拟实验研究,旨在揭示地层淋滤过程对再生水有机物总量的截留效能及其对DOM组成结构特征的影响,并基于实验结果,对地层溶出的主要成分腐植酸进行提取与表征,解析其可能的环境影响。
1 材料与方法
1.1 回灌模拟实验装置和采样方案
采用一维渗滤土柱模拟再生水回灌过程。有机玻璃土柱尺寸为高100 cm、内径10 cm。实验用土采自长春市某野外场地的砂质壤土,主要矿物成分为石英(45.8%)、斜长石(26.3%)、钾长石(9.8%)等,粒度中位径为0.38 mm。土样经过风干后过1 mm筛网去除粗砾,以避免明显的空间异质性,随后以每5 cm 600 g逐层夯实装柱,最终柱内模拟地层的体积密度为1.53 g/cm3,采用饱水法测得孔隙度为0.30。回灌水样取自长春市北郊污水处理厂再生水排放口,再生水处理工艺为二级出水→聚合氯化铝混凝沉淀过滤→氯消毒[7]。在柱子上端设置出水口,下端设置进水口,采用兰格BT100蠕动泵控制Q=10 mL/min的恒定上流模式,确保实验体系内的饱和渗流状态。以土柱饱水结束(水力停留时间为4 h)、出口开始流出水样为起始时刻,采用CBS100 A自动采集器连续收集出水样品以供分析测试。实验装置如图1所示。
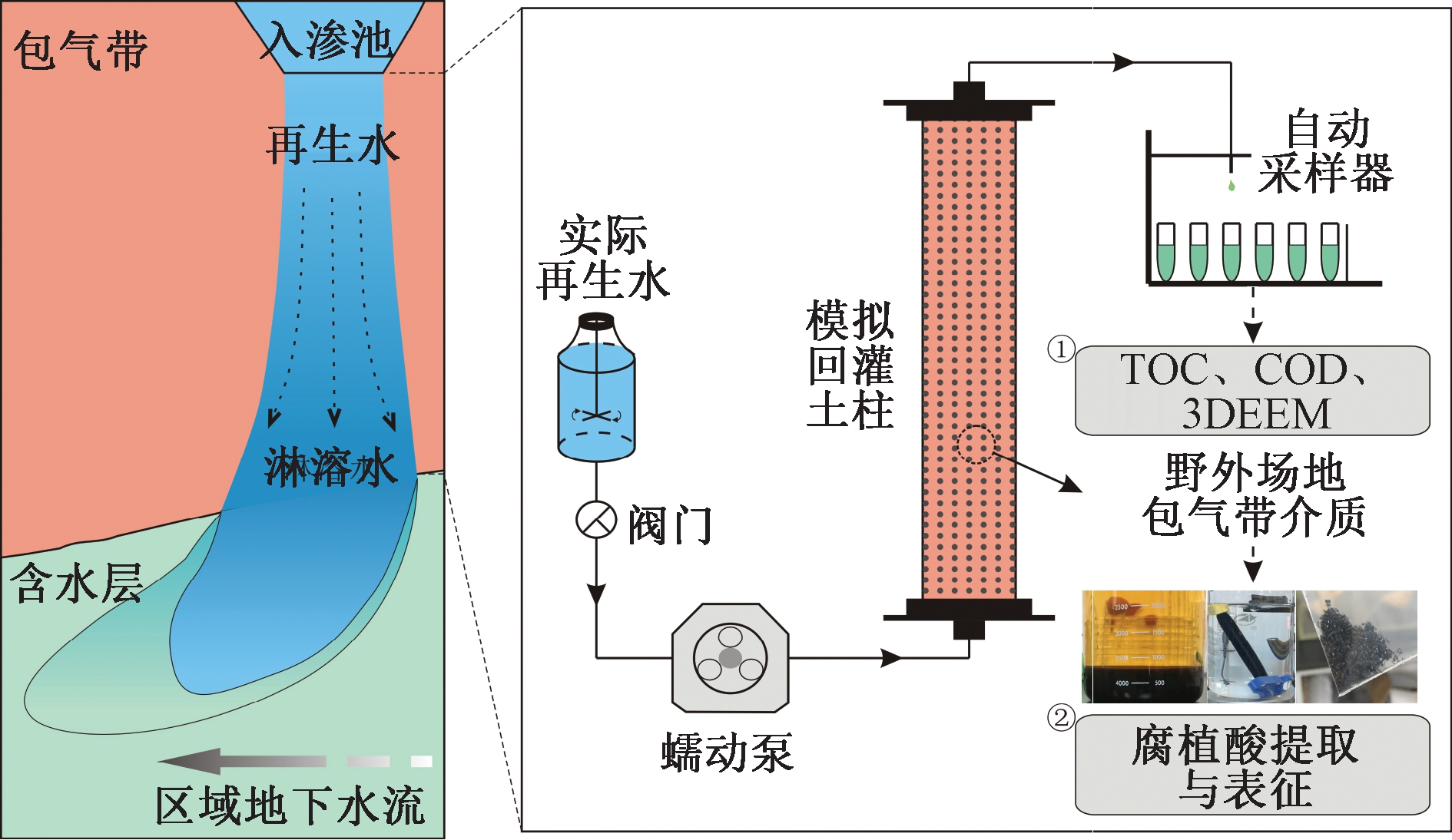
图1 再生水地下回灌过程及模拟柱实验示意
Figure 1 Schematic of the aquifer recharge with reclaimed water and simulated column experiment
1.2 柱实验出水样品测试分析方法
采用溶解性有机碳(DOC)和化学需氧量(COD)表征柱实验出水中有机物总量的变化,分别采用Shimadzu TOC-L 总有机碳分析仪和重铬酸钾比色法(GB/T 8538—2008)进行测定。出水样品DOM的组成结构采用三维荧光光谱分析法测定(Hitachi F-2700型荧光分光光度计)。激发光源为150 W氙灯,参数设定为:激发波长Ex:220~450 nm;发射波长Em:220~550 nm,波长扫描间隔均为5 nm;狭缝宽带:Ex=10 nm,Em=10 nm;扫描速度1500 nm/min;光电倍增管PMT电压400 V,在1 cm石英荧光比色皿中测量。所有水样在测量前需经过0.45 μm滤膜过滤。
1.3 荧光数据区域积分处理
首先对柱实验出水的三维荧光光谱数据进行干扰散射扣除,包括通过扣除超纯水的空白水样来消除拉曼散射(水分子的非弹性散射),通过Delaunay三角形内插值法消除瑞利散射,从而提高荧光光谱解析效率[8]。随后采用荧光区域积分法(FRI)对三维荧光光谱进行定量分析[9]。将激发/发射波长所形成的二维荧光分成5个区域,代表5种不同类型的有机物:区域Ⅰ代表类酪氨酸芳香族蛋白质(Ex=220~250 nm,Em=250~330 nm);区域Ⅱ代表类色氨酸芳香族蛋白质(Ex=220~250 nm,Em=330~380 nm);区域Ⅲ代表富里酸类物质(Ex=220~250 nm,Em=380~550 nm);区域Ⅳ代表溶解性微生物代谢产物(Ex=250~450 nm,Em=250~380 nm);区域Ⅴ代表腐植酸类物质(Ex=250~450 nm,Em=380~550 nm)。通过Origin 9.1计算荧光区域i积分体积Φi,即具有相似性质有机物的累积荧光强度,对荧光区域i的积分体积Φi进行标准化,得到荧光区域i的积分标准体积Φi,n,从而反映这一区域的特定结构有机物的相对含量,最后计算荧光区域i的积分标准体积占总积分标准体积的比例Pi,n。
1.4 腐植酸的提取纯化与表征
本实验是在国际腐殖质协会(IHSS)推荐方法的基础上,结合自身实验条件进行的,具体操作步骤如下:1)称取过筛填柱原状土样400 g,按照1∶10的固液比加入0.1 mol/L HCl,室温下振荡(150 r/min)1 h,离心分离上清液和土壤残渣;2)弃去上清液,土壤残渣中先加入NaOH溶液调节pH至7,然后在N2保护下加入0.1 mol/L的NaOH溶液调节最终固液比为1∶10,间歇振荡至少4 h,静置过夜。于次日离心分离(4000 r/min,20 min),收集上清液;3)取适量HCl加入上清液中,调节上清液pH为1,然后静置沉降12 h,离心分离(4000 r/min,20 min),弃去上清液,保留沉淀物;4)在N2保护下,取少量KOH溶液将沉淀物溶解,并添加一定量的固体KCl,然后离心分离(6000 r/min,20 min),保留上清液;5)取适量HCl加入上清液中,使上清液pH调节为1,然后静置沉降12 h,离心分离(4000 r/min,20 min)处理后弃去上清液,保留沉淀物;6)向沉淀物中加入适量的HCl-HF混合溶液,振荡12 h,离心分离(4000 r/min,20 min),去除上清液,保留沉淀物,重复3次进行提纯;7)将上述处理后的沉淀物转移至透析袋中(截留分子量为12000~14000 Da),在去离子水中透析,用0.1 mol/L AgNO3检测透析水中的Cl-,重复上述操作直至检测不出Cl-。采用烘干法干燥腐植酸,避光保存,备用。
采用美国FEI公司XL30 ESEM-FEG场发射环境扫描电子显微镜对样品的表面形貌及能谱进行分析;采用美国Nicolet 6700傅里叶红外光谱仪对样品进行官能团的测定,KBr压片法制样,扫描范围:4000~400 cm-1,分辨率0.125 cm-1;采用岛津UV-2450紫外可见分光光度计对样品进行光谱分析,扫描范围:200~700 nm,步长为1 nm,再测定E2/E3和E4/E6。E2/E3是指波长在280 nm和360 nm处的吸光度比值。E4/E6是指波长在465 nm和665 nm处的吸光度比值。E2/E3、E4/E6分别是腐植酸的重要参数,其值大小可以反映腐植酸的芳香性和分子量的大小[11]。
2 结果与讨论
2.1 出水中溶解性有机物总量变化
再生水回灌过程中不同时间段淋滤出水的COD和DOC变化趋势见图2,其中虚线为再生水的COD(57.90 mg/L)和DOC(12.40 mg/L)含量。可知:在初始时刻COD和DOC含量都有所增加。由于土壤有机物含量的本底值较高,w(COD)和w(DOC)分别为351.20,195.75 mg/kg,因此回灌出水中COD和DOC含量的增加与回灌过程中土壤有机物的浸出有关[12]。此外,DOC含量的增加也可能是由于模拟土柱中微生物产生的溶解性胞外副产物引起的[13]。因为土柱中的溶解性微生物产物会因外界胁迫而增加,如缺乏营养物质和低pH环境[14]。COD含量在回灌第60小时时出现略微下降的现象,结合图2b分析,这种现象可能是由测量误差引起的。随着回灌的进行,COD和DOC含量出现下降趋势,且逐渐趋于平缓,直至回灌结束的第159小时。最终ρ(COD)保持在20 mg/L左右,去除率达到63%;ρ(DOC)则保持在7 mg/L左右,去除率达到42%。后期COD和DOC含量持续降低可能是因为土壤中的矿物成分较小的颗粒结构产生了吸附作用,从而使得其去除效果显著增加[12]。溶解性有机物总量经回灌后有所降低,表明再生水回灌补给地下水过程中,土壤含水层处理可一定程度实现溶解性有机物的去除。考虑渗滤地层净化效能进而设计地表靶向深度处理工艺,有望节约二级出水深度处理的成本。
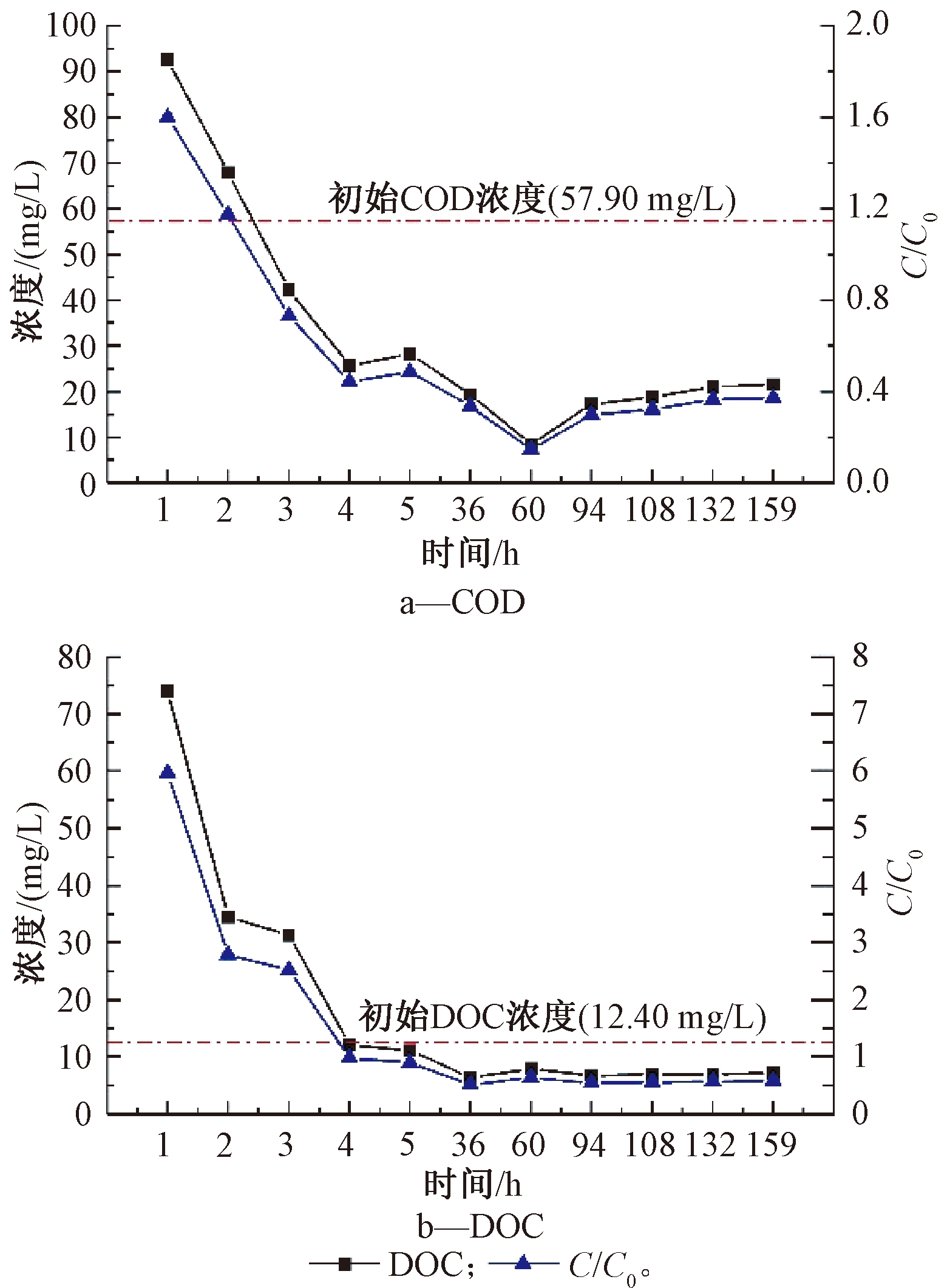
图2 COD和DOC随回灌时间的变化
Figure 2 Changes of COD and DOC with recirculation time
2.2 DOM组成结构的荧光光谱解析
再生水、不同时间段的淋滤出水以及土壤溶液的三维荧光光谱见图3。可知:再生水水样的荧光光谱中有2个较为明显的荧光峰。其特征荧光峰的中心位置分别在Ex=230、Em=345 nm处和Ex=280,Em=355 nm处。此外,再生水的溶解性有机物构成以类色氨酸芳香族蛋白质和溶解性微生物代谢产物为主,腐植酸类物质含量较少,这与其他研究结果具有一致性[15,16]。随着回灌实验的进行,水样的三维荧光光谱特征逐渐发生了变化,位于区域Ⅱ和区域Ⅳ的荧光特征峰消失,伴随出现的是区域Ⅲ或区域Ⅴ的荧光特征峰,并且愈加明显。区域Ⅱ荧光峰的消失说明结构简单的荧光物质如蛋白质类物质容易被微生物降解。最终出水的特征荧光峰的中心位置位于Ex=250,Em=410 nm处,表明经过回灌处理后,最终出水中的溶解性有机物主要成分为腐植酸类物质。
由于传统的峰值法未能从本质上反映出复杂的各荧光物质在总荧光中的分布及环境行为,因此为了更加详细地区别不同样品DOM的组成比例,对所获得三维荧光光谱进行了荧光区域积分,各区域的积分值占总积分值的比例见图4。
由图4可知:色氨酸芳香族蛋白质和溶解性微生物代谢产物为再生水中溶解性有机物的主要成分,所占比例分别为33.8%和22.9%。土壤中Ⅰ—Ⅴ类荧光物质的占比依次为2.1%、6.5%、18.2%、16.7%、56.4%,表明土壤中腐植酸类物质含量较多;经回灌后,最终出水中溶解性有机物组成和含量较进水发生较大变化,区域Ⅱ和Ⅳ所占比例有所降低,且分别降至为5.1%和18.5%。这与图3的现象一致,表明溶解性有机物中的类色氨酸芳香族蛋白质容易被微生物降解,此外吸附对蛋白质类物质的去除也起到重要作用[17];另一方面,区域Ⅴ所占比例显著增大至61.0%,腐植酸类物质为最终出水中的主要成分。结合土壤的荧光光谱图可知,区域Ⅴ所占比例增大表明随着回灌过程的进行,土壤本身的腐植酸类物质被淋溶释放。腐植酸类物质的增加也从侧面印证其不易被微生物降解甚至难降解。

图3 再生水、淋滤出水和土壤溶液的三维荧光光谱分布
Figure 3 EEM distribution of charged water, effluents and soil solution in experiment

图4 溶解性有机物的FRI分布
Figure 4 Distribution of FRI in dissolved organic matter
2.3 腐植酸表征结果
腐植酸的扫描电镜图像见图5a。可知:腐植酸表面呈海绵状,海绵状结构有利于其在固-液界面中暴露极性官能团,促进其与环境中其他物质的相互作用[18]。图5b为腐植酸的能谱图。可知:腐植酸主要由C、O 2种元素组成,C和O元素的质量分数分别为64.4%和34.25%。
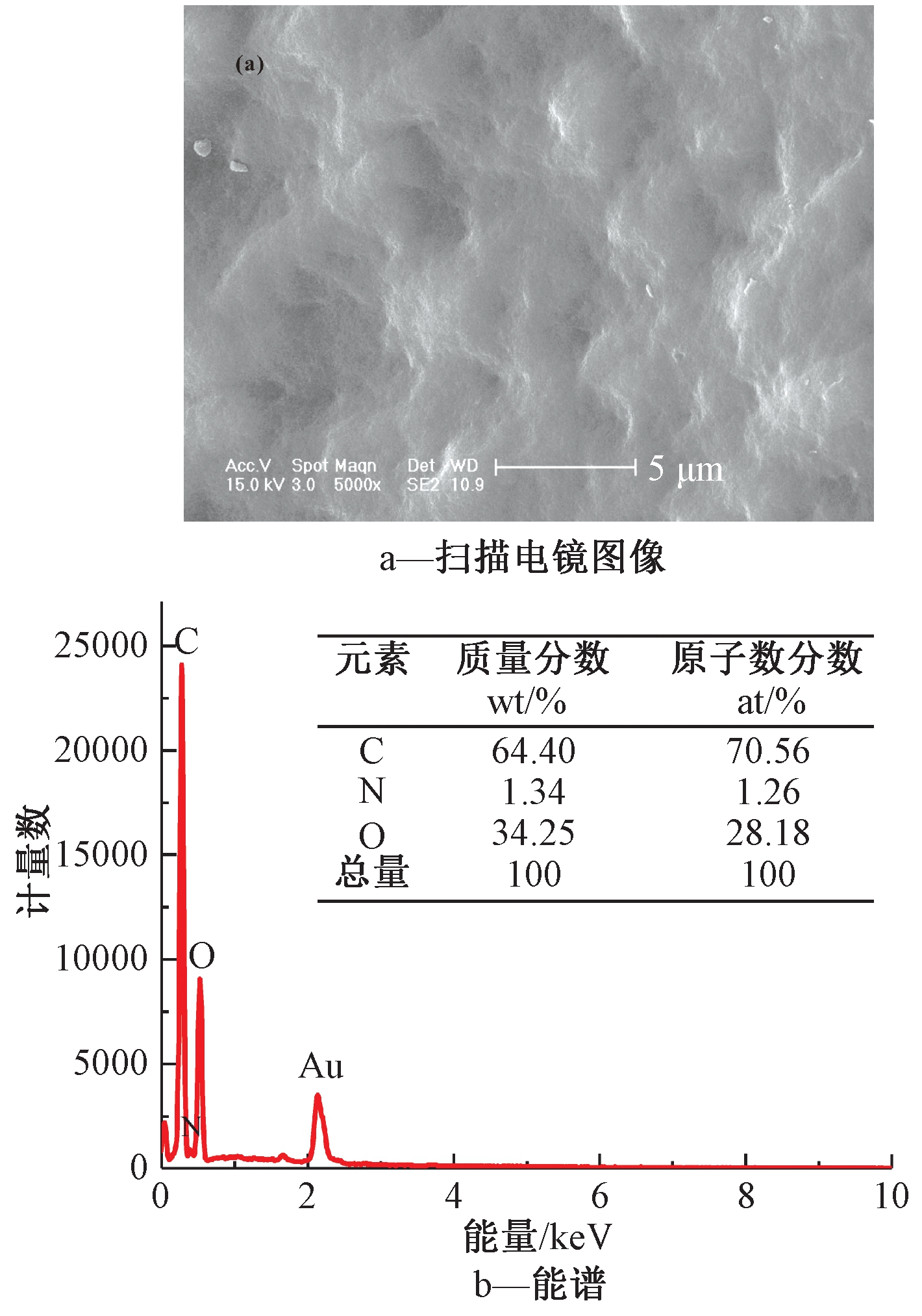
图5 腐植酸的扫描电镜和能谱
Figure 5 SEM image and EDS atlas of humic acid
腐植酸的傅里叶红外光谱如图6a所示。可知:3272 cm-1处出现的特征峰是缔合—OH伸缩振动所致,该—OH振动可能是酚、醇或羧基导致的;2921 cm-1处的特征峰为脂肪族中烷烃结构中CH2和CH3伸缩振动产生,但此处表现不明显,表明腐植酸分子中脂肪链结构较少,芳环结构较多;在1630 cm-1显示出醛、酮、羧酸、酯的C![]() O伸缩振动吸收带;1232 cm-1处出现的特征峰对应—COOH中C—O伸缩以及O—H的变形[19,20]。光谱结果表明,腐植酸中含有—OH、C
O伸缩振动吸收带;1232 cm-1处出现的特征峰对应—COOH中C—O伸缩以及O—H的变形[19,20]。光谱结果表明,腐植酸中含有—OH、C![]() O、—COOH等活性官能团。研究表明,这些官能团的存在可通过静电作用、吸附、氢键、配体交换、共价键、范德华力、疏水作用等多种作用与有机污染物结合,影响回灌过程中有机污染物的吸附和解吸,从而影响它们的迁移与截留。Bai等[21]开展了腐植酸对卡马西平迁移影响的实验,结果表明,腐植酸与卡马西平之间的疏水作用促进了卡马西平在土壤中的迁移能力。Henry等[22]研究发现,腐植酸易通过氢键和有机氯农药形成三维结构的微聚体,增加其在水相中的分布,从而促进有机氯农药的迁移。
O、—COOH等活性官能团。研究表明,这些官能团的存在可通过静电作用、吸附、氢键、配体交换、共价键、范德华力、疏水作用等多种作用与有机污染物结合,影响回灌过程中有机污染物的吸附和解吸,从而影响它们的迁移与截留。Bai等[21]开展了腐植酸对卡马西平迁移影响的实验,结果表明,腐植酸与卡马西平之间的疏水作用促进了卡马西平在土壤中的迁移能力。Henry等[22]研究发现,腐植酸易通过氢键和有机氯农药形成三维结构的微聚体,增加其在水相中的分布,从而促进有机氯农药的迁移。
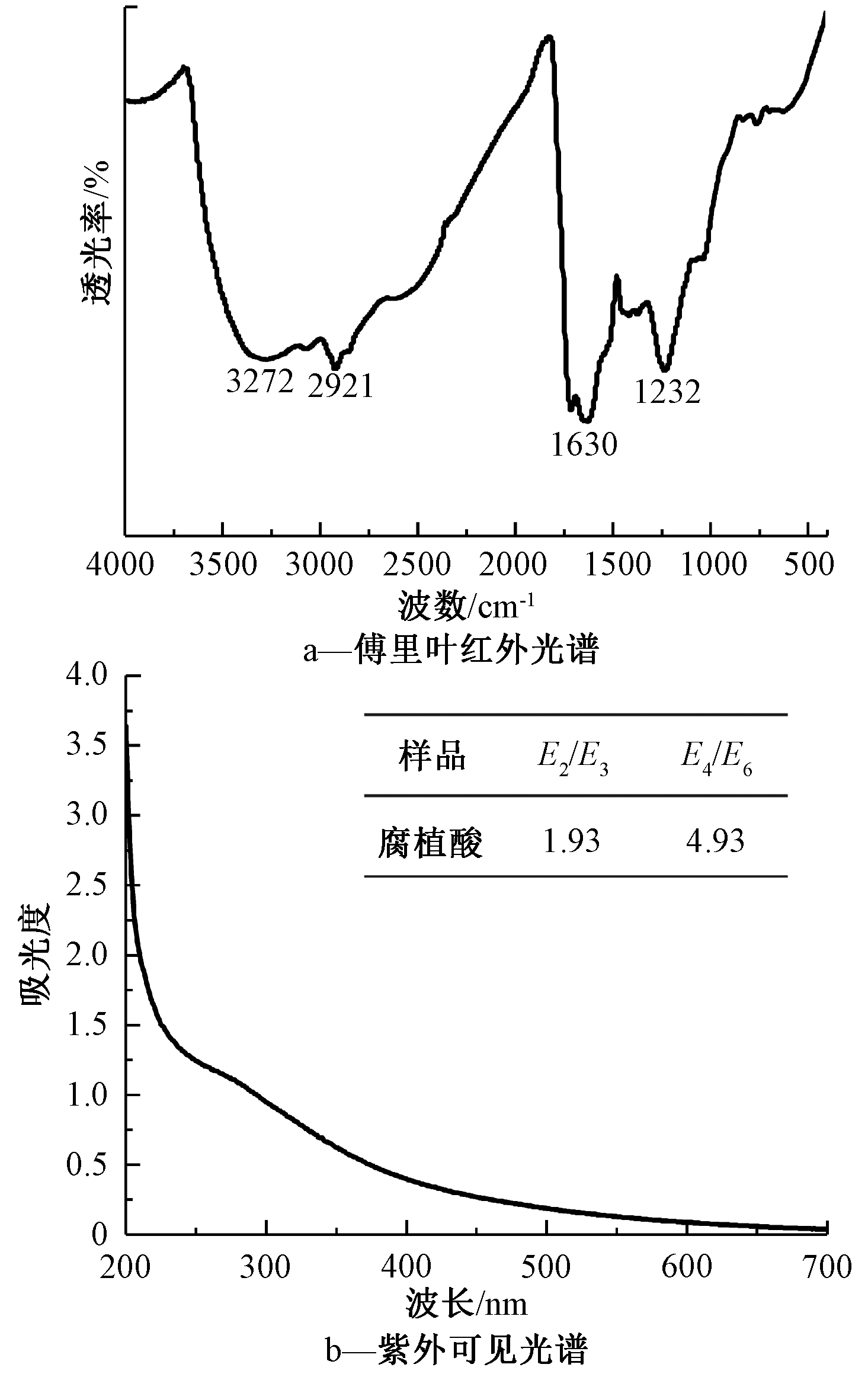
图6 腐植酸的傅里叶红外光谱和紫外可见光谱
Figure 6 FTIR and UV-Vis Spectra of humic acid
腐植酸的紫外可见光谱见图6b。可知:吸光度随着波长的增加而减少,且在278 nm附近出现象征芳香结构的肩峰[23];与可见光区域相比,紫外区域的吸光度下降更快。本次实验中提取的腐植酸的E2/E3和E4/E6值分别为1.93和4.93,表明提取的腐植酸属于大分子范畴[24]。将实验中提取的HA与IHSS HA[19]进行对比分析,结果表明,提取的HA在元素组成上与IHSS HA一致,主要元素为C、O元素;红外光谱图显示两者在3379~3272,2970~2921,1630~1620,1232~1207 cm-1存在明显的吸收;紫外可见光谱图结果基本相似,光谱图均呈现吸光度随波长的增加而降低的特征。因此,可认为实验提取的HA已基本达到国际标准水平。
3 结 论
1)在再生水地下回灌过程中,初始阶段,由于包气带土壤中溶解性有机物的释放将导致淋滤水中有机物含量的升高,但随回灌过程的持续进行,最终其COD和DOC含量均有所下降,ρ(COD)稳定在20 mg/L左右,去除率达到63%;ρ(DOC)稳定在7 mg/L左右,去除率达到42%。
2)三维荧光结合区域积分对再生水、不同时间段淋滤出水以及土壤溶液的分析结果表明,再生水中溶解性有机物以芳香蛋白类物质和溶解微生物代谢产物为主,土壤中则以腐植酸类物质为主。随着回灌的进行,出水中溶解性有机物的组成成分发生了显著变化,主要为腐植酸类物质,表明在再生水地下回灌过程中,水中的蛋白质类物质被吸附而土壤本身含有的腐植酸类物质和富里酸类物质被淋溶释放。
3)对提取并纯化后的腐植酸进行表征,结果表明腐植酸表面呈海绵状,有利于其在固-液界面中暴露极性官能团,促进其与环境中其他物质发生作用。腐植酸主要由C、O元素组成。红外光谱分析结果表明,腐植酸中含有羟基和羧基等活性官能团,且腐植酸分子中脂肪链结构较少,芳环结构较多。这些官能团的存在可能使其与水中共存污染物发生相互作用,从而影响其最终归宿。紫外可见光谱呈现单调而无特征性的现象,仅在278 nm处出现了象征芳香结构的肩峰。
[1] 肖宇. 高碑店污水处理厂二级出水深度处理后用于地下回灌的再生污水健康风险评价 [D]. 北京:中国地质大学(北京), 2005.
[2] 魏亮亮, 赵庆良, 薛爽,等. 二级出水经地下水回灌后的梯级利用及安全评价 [J]. 中国给水排水, 2012, 28(19):78-83.
[3] MICHAEL-KORDATOU I, MICHAEL C, DUAN X, et al. Dissolved effluent organic matter: characteristics and potential implications in wastewater treatment and reuse applications [J]. Water Research, 2015, 77:213-248.
[4] 唐东民. 溶解性有机质的动态变化及其对有机物吸附解吸的影响 [D]. 四川:四川农业大学, 2008.
[5] 白英臣. 天然溶解有机质和环境污染物的相互作用:以铜、汞离子和卡马西平为例 [D]. 北京:中国科学院地球化学研究所,2007.
[6] 李峰. 再生水补给地下水过程中水文地球化学作用的模拟研究 [D]. 北京:中国地质大学(北京), 2015.
[7] 张晗. 再生水地下储存过程中的水质变化及水文地球化学演化规律研究 [D]. 长春:东北师范大学, 2018.
[8] MORTEZA B, RASMUS B, COLIN S, et al. Handling of Rayleigh and Raman scatter for PARAFAC modeling of fluorescence data using interpolation [J]. Journal of Chemometrics, 2010, 20(3/4):99-105.
[9] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2015, 37(24):5701-5710.
[10] SHOZO K, AKIRA W, KAZUHITOITOH, et al. Comparison of two methods of preparation of humic and fulvic acids, IHSS method and NAGOYA method [J]. Soil Science & Plant Nutrition, 2006, 38(1):23-30.
[11] ZHANG S, YUAN L, LI W, et al. Characterization of pH-fractionated humic acids derived from Chinese weathered coal [J]. Chemosphere, 2017, 166:334-342.
[12] ESSANDOH H M K, TIZAOUI C, MOHAMED M H A. Removal of dissolved organic carbon and nitrogen during simulated soil aquifer treatment [J]. Water Research, 2013, 47(11):3559-3572.
[13] WESTERHOFF P, PINNEY M. Dissolved organic carbon transformations during laboratory-scale groundwater recharge using lagoon-treated wastewater [J]. Waste Management, 2000, 20(1):75-83.
[14] JARUSUTTHIRAK C, AMY G. Understanding soluble microbial products (SMP) as a component of effluent organic matter (EfOM) [J]. Water Research, 2007, 41(12):2787-2793.
[15] 崔晓春. 再生水中余铝对生物堵塞和生物膜形成的影响与作用机制 [D]. 长春:东北师范大学, 2017.
[16] WU L L, ZHAO X, ZHANG M. Removal of dissolved organic matter in municipal effluent with ozonation, slow sand filtration and nanofiltration as high quality pre-treatment option for artificial groundwater recharge [J]. Chemosphere, 2011, 83(5):693-699.
[17] FOX P, ABOSHANP W, ALSAMADI B. Analysis of soils to demonstrate sustained organic carbon removal during soil aquifer treatment[J]. Journal of Environmental Quality, 2005, 34(1):156-163.
[18] N GRE M, VINDROLA D, SPERA S, et al. Effect of the chemical composition of soil humic acids on their viscosity, surface pressure,and morphology [J]. Soil Science, 2002, 167(10):636-651.
GRE M, VINDROLA D, SPERA S, et al. Effect of the chemical composition of soil humic acids on their viscosity, surface pressure,and morphology [J]. Soil Science, 2002, 167(10):636-651.
[19] 林樱. 土壤、沉积物以及蓝藻中有机质标准物质的提取与表征 [D]. 北京:中国环境科学研究院, 2011.
[20] LI L, ZHAO Z Y, HUANG W L, et al. Characterization of humic acids fractionated by ultrafiltration [J]. Organic Geochemistry, 2004, 35(9):1025-1037.
[21] BAI Y, WU F, LIU C, et al. Interaction between carbamzepine and humic substances: a fluorescence spectroscopy study [J]. Environmental Toxicology and Chemistry, 2008, 27(1):95-102.
[22] HENRY V M. Association of hydrophobic organic contaminants with soluble organic matter: evaluation of the database of K doc values [J]. Advances in Environmental Research, 2002, 6(4):577-593.
![]() L, BURD
L, BURD KOV
KOV -SZEWIECZKOV
-SZEWIECZKOV J, ENEV V, et al. Spectral characterization and comparison of humic acids isolated from some European lignites [J]. Fuel, 2018, 213:123-132.
J, ENEV V, et al. Spectral characterization and comparison of humic acids isolated from some European lignites [J]. Fuel, 2018, 213:123-132.
[24] 毛静春. 中国干旱半干旱草原地区土壤中腐殖质的提取与表征研究 [D]. 哈尔滨:哈尔滨工业大学, 2015.