0 引 言
在实际废水生物脱氮工艺中,硝化-反硝化是传统生物脱氮的典型工艺,工业化应用广泛。含氨废水成分复杂,硝化系统抑制现象时常发生[1]。当废水生物处理工艺受到水质或水量冲击时,通过添加高效菌可以增强系统内功能微生物活性,是改善生物处理单元效能的有效方法[2-6]。其中,高效菌的投加方式、菌种类型及其与原生菌群的相互作用等均会影响生物强化的效果[7]。针对小试规模的新型生物脱氮系统,当受到高浓度土霉素抑制时,采取菌群流加的强化策略(即投加经过扩大培养的硝化细菌)能够较好地恢复其生物脱氮性能[8,9]。在硝化-厌氧氨氧化工艺中,当受到氯四环素抑制时,通过流加厌氧氨氧化菌也具有较好的恢复性能[10];在中试规模硝化-反硝化系统中,通过流加异养好氧菌能够改善微生物群落结构,也可提高有机污染物和氨氮的去除[11]。然而针对工业规模硝化系统抑制后,尤其对于长期受到抑制且通过常规调控手段难以恢复的硝化系统,生物强化恢复策略的可行性尚缺乏研究,实施过程中存在的关键问题仍不明确,需要通过实际工业规模系统进行考察验证。
某大型煤化工硝化系统采用降低水量和逐渐驯化恢复硝化系统等常规恢复策略,但通过近8个月的调试硝化系统仍未恢复。鉴于硝化系统长期抑制难以恢复的现状,本文拟通过小试和工业规模试验,探究生物强化恢复策略的可行性及其存在的问题,为长期受抑制的工业规模硝化系统的快速恢复提供参考。
1 材料与方法
1.1 废水水质及其处理工艺流程
某大型煤化工废水主要来源为煤气化废水、甲醇废水及部分生活污水(图1)。处理水量为850 m3/h,其中废水中ρ(COD)为1300~4000 mg/L,进水![]() 为150~200 mg/L,pH呈中性。废水经调节池后分为4组平行系列,依次经过厌氧水解酸化池和A/O池,然后经二沉池溢流出水,再经活性焦吸附、曝气生物滤池和变孔隙滤池,其工艺流程详见图1。
为150~200 mg/L,pH呈中性。废水经调节池后分为4组平行系列,依次经过厌氧水解酸化池和A/O池,然后经二沉池溢流出水,再经活性焦吸附、曝气生物滤池和变孔隙滤池,其工艺流程详见图1。
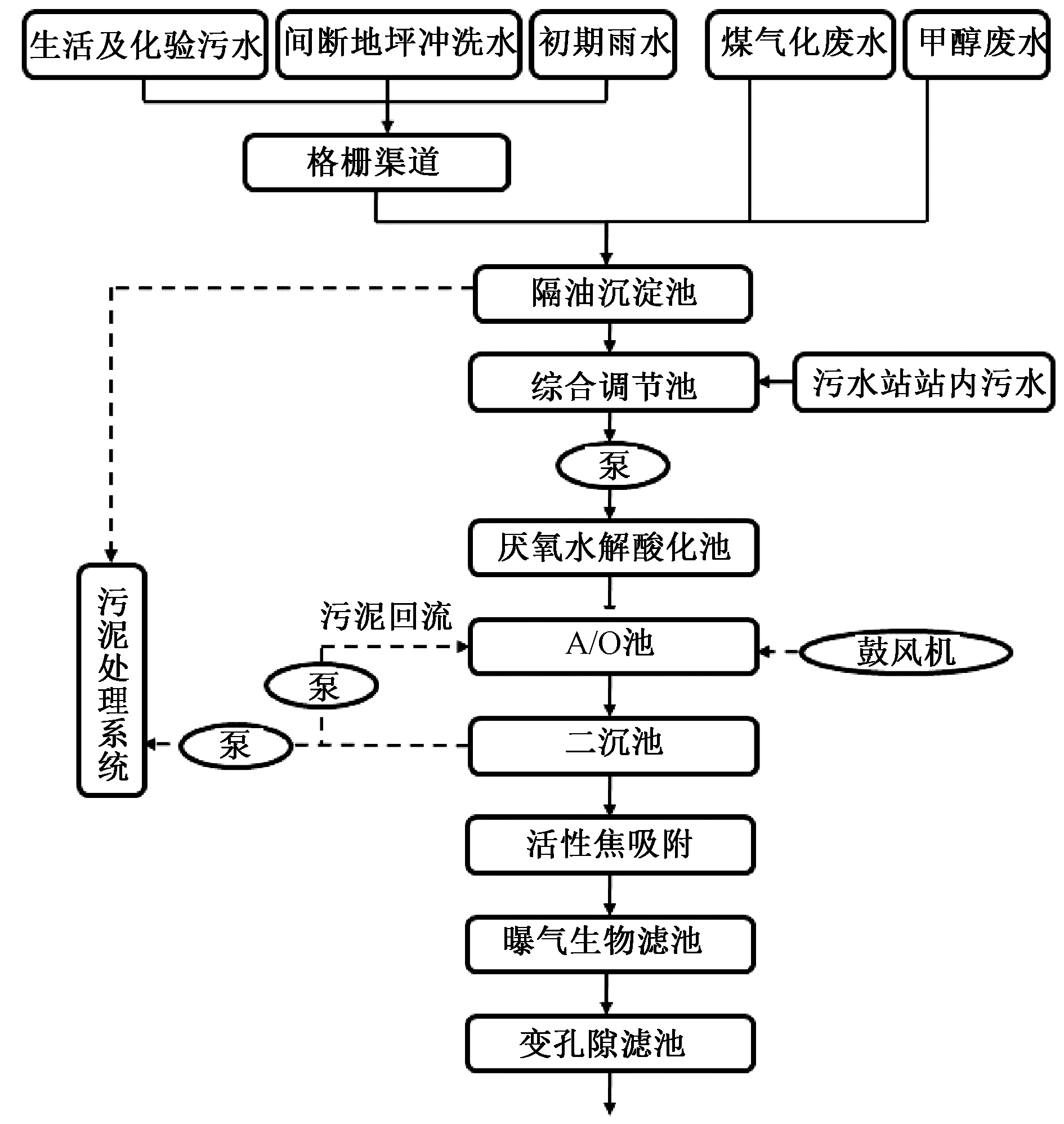
图1 工业规模硝化系统工艺流程
Figure 1 Schematic diagram of the full-scale nitrification system
1.2 试验方法
试验采取小试规模试验和工业规模试验结合的方式进行。首先,在小试规模试验中,从好氧池和二沉池中取水样,投加一定量的硝化菌,探究投加高效硝化菌对实际废水中氨氮的降解效果。在工业规模试验中,选取4组平行系列中的一个系列作为试验组,剩余3个系列作为对照组。在试验组好氧池投加硝化菌前,停止试验组进水72 h,控制SV30在75%左右。当试验组二沉池出水COD稳定在150~200 mg/L,出水氨氮稳定在100 mg/L以下,开始向试验组硝化池内持续流加高活性的硝化菌。其中硝化菌间歇定时投加于好氧池进水端。硝化菌流加过程中及时调控好氧池内温度、pH和DO等,同时及时跟踪数据变化调整进水量和菌群投加量。根据二沉池出水中有机物、总磷和碱度的检测结果,为硝化菌和反硝化菌提供充足的碳源和磷源。对照组除不投加高效硝化菌外。其他环境条件及调控措施与试验组相同。
1.3 高效硝化菌及其硝化速率
硝化菌选用某商用高效硝化菌,添加前均密闭储藏,环境温度控制在4~10 ℃,其颜色为粉红色-棕色浑浊液体,每小时每千克硝化菌混合液氨氮转化量约为500 mg。
1.4 测定项目与方法
氨氮![]() 硝氮
硝氮![]() 亚硝氮
亚硝氮![]() 污泥浓度(SS)、COD、总磷、总酚、碱度和SV30均采用APHA标准方法测定[12];pH采用便携式pH测定仪(Horiba, Kyoto, 日本)测定。
污泥浓度(SS)、COD、总磷、总酚、碱度和SV30均采用APHA标准方法测定[12];pH采用便携式pH测定仪(Horiba, Kyoto, 日本)测定。
2 结果与讨论
2.1 小试规模试验
首先从好氧池和二沉池出水取样,通过添加高效硝化菌进行小试,探究高效硝化菌对于实际废水中![]() 的去除效果。图2为小试规模试验中
的去除效果。图2为小试规模试验中![]() 和
和![]() 变化。可知:相比未投加硝化菌的平行对照组,投加硝化菌的试验组好氧池和二沉池出水中
变化。可知:相比未投加硝化菌的平行对照组,投加硝化菌的试验组好氧池和二沉池出水中![]() 浓度均显著降低,同时
浓度均显著降低,同时![]() 浓度明显增加;不投加硝化菌的对照组,
浓度明显增加;不投加硝化菌的对照组,![]() 也略有降低,但几乎无
也略有降低,但几乎无![]() 生成,其去除主要以同化和吹脱为主。魏继林等[13]通过添加硝化菌后,发现
生成,其去除主要以同化和吹脱为主。魏继林等[13]通过添加硝化菌后,发现![]() 的去除率能够保持在90%以上;Salea等[14]研究表明:经过生物强化的SBR系统在26~32 d时出水氨氮浓度低于5 mg/L。因此,通过该高效硝化菌的投加,能够快速建立硝化反应,实现氨氮的快速生物降解转化。
的去除率能够保持在90%以上;Salea等[14]研究表明:经过生物强化的SBR系统在26~32 d时出水氨氮浓度低于5 mg/L。因此,通过该高效硝化菌的投加,能够快速建立硝化反应,实现氨氮的快速生物降解转化。
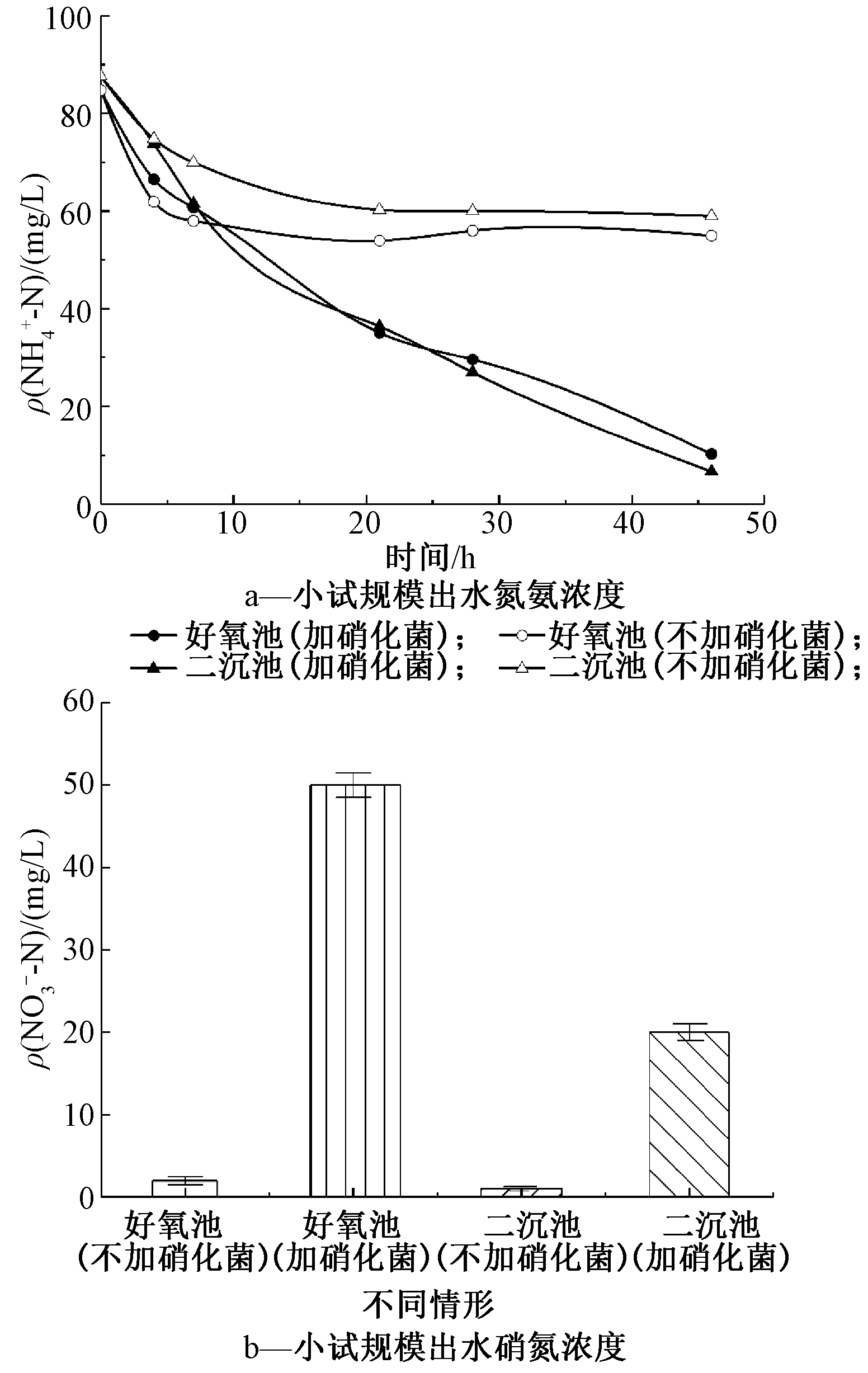
图2 小试规模试验出水氨氮和硝氮浓度变化
Figure 2 Change of ![]() and
and ![]() concentration in the effluent of the aerobic and secondary settling tanks
concentration in the effluent of the aerobic and secondary settling tanks
2.2 工业规模试验
2.2.1 各物质流加量与流加时间
相应的流加量及其持续流加时间如图3所示。在前期(0~5 d)由于试验组性能尚未得到恢复,因此每天流加的硝化菌量较大且进水量小于100 m3/h。在第5天后,硝化菌投加量和进水量维持稳定。在工业规模试验中,由于来水水质复杂程度不同于小试,为增加水中COD与碳源比值(BOD/C),促进微生物的降解,故在硝化菌流加期间向试验组间歇定时投加Na2CO3、CH3OH和Na3PO4(图3)。
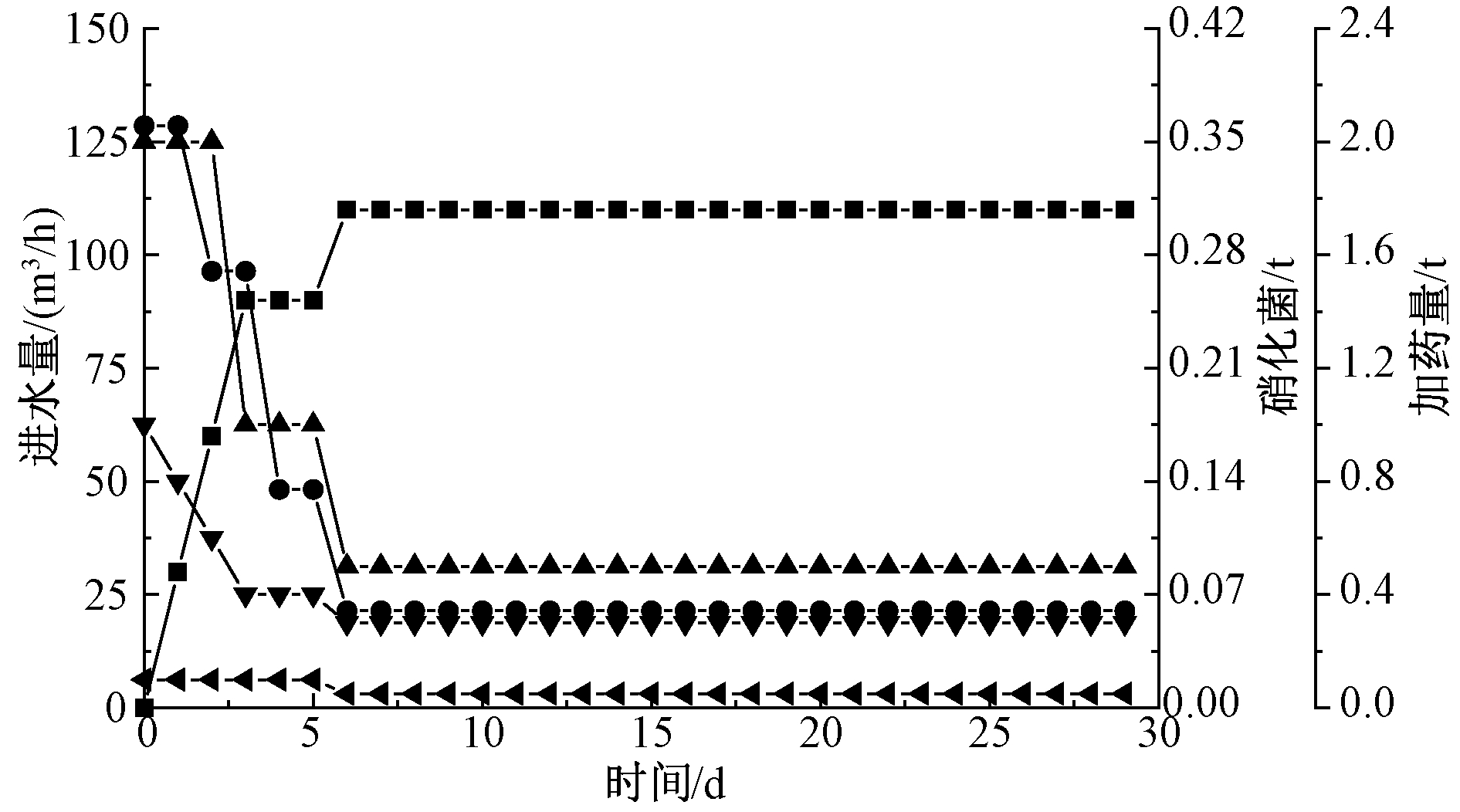
![]() —进水量;
—进水量; ![]() —硝化菌;
—硝化菌; ![]() —Na2CO3;
—Na2CO3; ![]() —Na3PO4;
—Na3PO4; ![]() —CH3OH。
—CH3OH。
图3 工业规模硝化系统生物强化阶段试验组硝化系统进水量和碳源、磷源投加量以及高效硝化菌投加量的变化曲线
Figure 3 Changes of inflow and the dosages of carbon source, phosphorus source and nitritation bacteria during the bio-augmentation period of the full-scale nitrification system
2.2.2 镜 检
在废水生物处理过程中,原生动物的出现能够较好地评估废水生物处理性能[15]。在硝化菌流加期间(0~29 d),镜检发现试验组硝化系统污泥中原后生动物(少量游泳型纤毛虫、累枝虫和轮虫)逐渐显现(图4),同时有丝状菌出现。因此,可推测试验组硝化污泥环境趋于好转,废水中潜在毒性有所缓解。
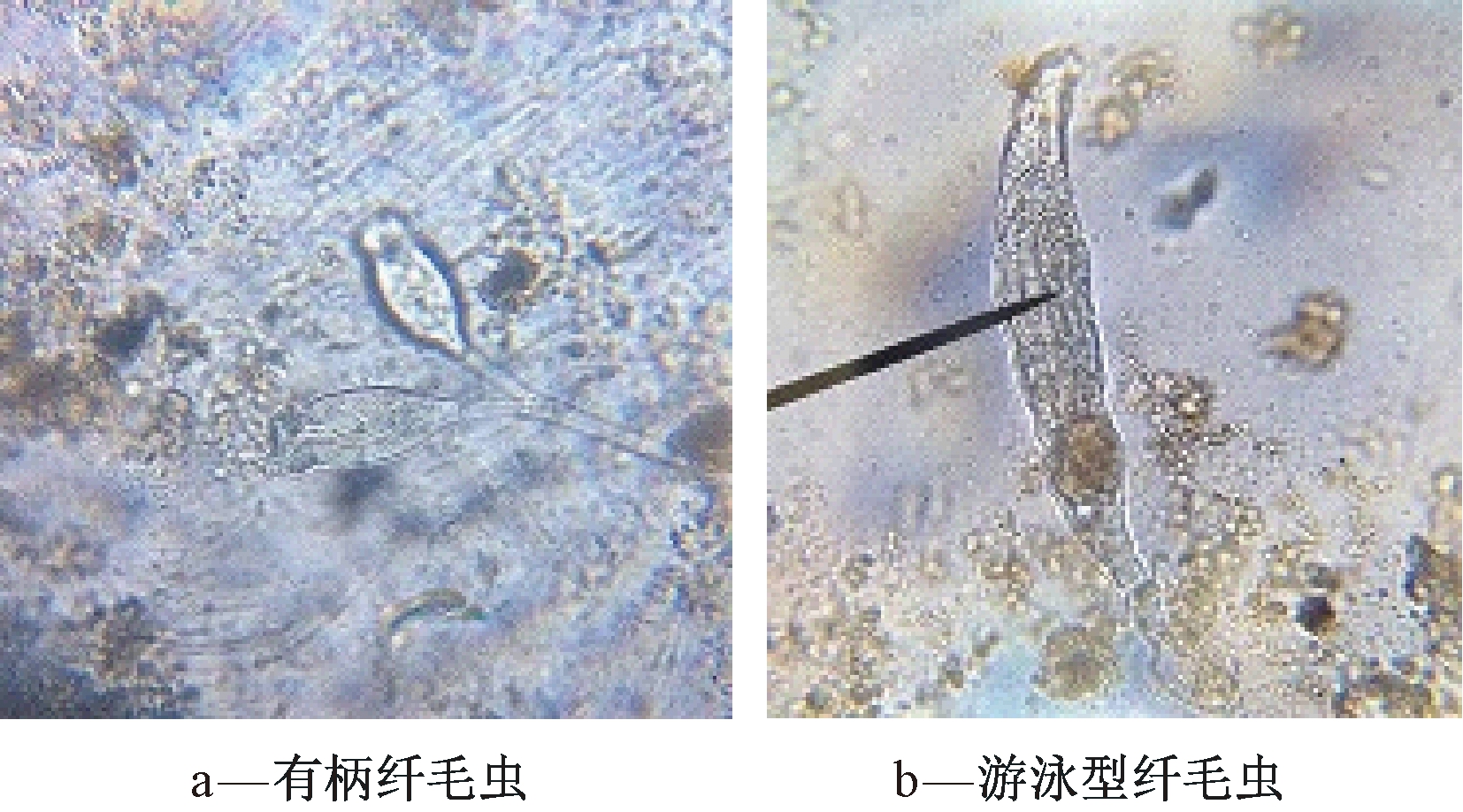
图4 工业规模硝化系统生物强化阶段后期试验组硝化污泥镜检
Figure 4 The microscopic pictures of the nitritation sludge during the bio-augmentation end period of the full-scale nitrification system
在菌群流加恢复前期(30~60 d),试验组与对照组出水氨氮、碱度和pH均相差不大(图5)。在流加菌群初期,试验组出水中碱度无显著降低,表明相应的硝化反应仍未形成。硝化反应建立时间显著长于小试结果,分析原因在于:小试中高效硝化菌污泥浓度较高,相同抑制物存在的情况下仍然能够高效降解氨氮,但工业规模硝化系统内的土著硝化菌已经严重抑制且流加的高效硝化污泥浓度相对较少,使得菌群流加后硝化系统较长时间内仍未恢复。在菌群流加恢复后期(87~105 d),试验组出水![]() 碱度和pH均出现较大程度的降低,而对照组未出现降低趋势。由图5可知:与菌群流加恢复前期相比,恢复后期进水中总酚浓度由(27.36±5.32) mg/L逐渐降至(0.58±0.27) mg/L,试验组出水氨氮浓度也随之逐渐降低。酚类物质是煤化工废水中常见的一种抑制物,苯酚类物质对微生物的抑制作用主要源于两方面:1)苯酚类物质会透过细胞膜与磷脂双分子层结合,导致细胞膜发生破坏,影响酶蛋白的主动运输以及细胞呼吸、能量代谢的紊乱[16];2)氨单加氧酶是氨氮氧化过程中所必需的一种酶,苯酚可以作为一种替代的基质与氨单加氧酶结合,影响氨氮氧化的进程[17]。由此可知,较高浓度的总酚是硝化系统菌群流加后快速建立硝化反应的重要限制因子。然而,随着进水中总酚浓度降低,对照组中硝化系统均未恢复,说明即使降低总酚浓度,对照组硝化系统也很难通过长时间自身菌群适应逐渐恢复硝化性能。由此可以推测:如果菌群流加前先降低总酚浓度,试验组硝化系统可能更易恢复。因此,针对工业规模硝化系统抑制后,需要首先识别抑制物并最大限度地降低抑制物浓度,然后通过菌群流加策略,可以快速地恢复硝化反应。
碱度和pH均出现较大程度的降低,而对照组未出现降低趋势。由图5可知:与菌群流加恢复前期相比,恢复后期进水中总酚浓度由(27.36±5.32) mg/L逐渐降至(0.58±0.27) mg/L,试验组出水氨氮浓度也随之逐渐降低。酚类物质是煤化工废水中常见的一种抑制物,苯酚类物质对微生物的抑制作用主要源于两方面:1)苯酚类物质会透过细胞膜与磷脂双分子层结合,导致细胞膜发生破坏,影响酶蛋白的主动运输以及细胞呼吸、能量代谢的紊乱[16];2)氨单加氧酶是氨氮氧化过程中所必需的一种酶,苯酚可以作为一种替代的基质与氨单加氧酶结合,影响氨氮氧化的进程[17]。由此可知,较高浓度的总酚是硝化系统菌群流加后快速建立硝化反应的重要限制因子。然而,随着进水中总酚浓度降低,对照组中硝化系统均未恢复,说明即使降低总酚浓度,对照组硝化系统也很难通过长时间自身菌群适应逐渐恢复硝化性能。由此可以推测:如果菌群流加前先降低总酚浓度,试验组硝化系统可能更易恢复。因此,针对工业规模硝化系统抑制后,需要首先识别抑制物并最大限度地降低抑制物浓度,然后通过菌群流加策略,可以快速地恢复硝化反应。
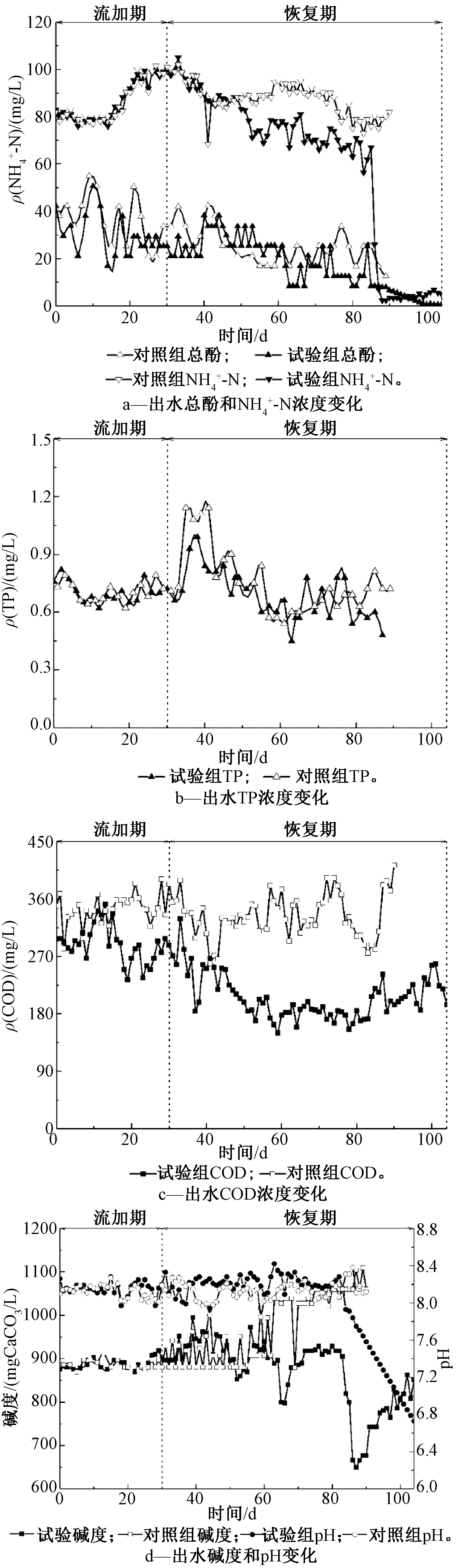
图5 工业规模试验中试验组和对照组中苯酚![]() COD、pH和碱度变化
COD、pH和碱度变化
Figure 5 Changes of total phenol, ![]() total phosphorus, COD, pH and alkalinity in the full-scale nitrification system and control
total phosphorus, COD, pH and alkalinity in the full-scale nitrification system and control
2.3 工业规模硝化系统生物强化策略关键问题
工业规模硝化系统受到长期抑制需进行高效菌流加生物强化恢复前,需要筛选合适的硝化菌类型。通常微生物通过长期驯化能够适应一定浓度的抑制物,所流加硝化菌原有培养条件与实际工况的差异,是取决菌群流加生物强化效果的重要因素[18,19]。因此,在选择外加硝化菌进行生物强化恢复时,选择与待恢复工艺单元进水水质相似的其他污水处理厂硝化排泥,能够实现受抑制硝化系统低成本高效快速的恢复,同时降低其他污水处理厂剩余污泥的处理成本。
其次,投加量对于生物强化的效果影响也较为显著。Dilrika等[20]发现,当反应温度由22 ℃降到4 ℃,COD投加量为133 mg/L时,对硝化速率的提高不显著,但当投加量增至200~333 mg/L时,硝化速率显著提升。本研究小试中,硝化菌投加量相对较高,氨氮效果显著;但在工业规模试验中,硝化菌投加量较低,也是试验组硝化系统恢复缓慢的原因之一。投加量过小,则无法达到预期的效果;投加量过大,则运行成本增加[21]。因此,需要根据硝化系统处理规模,依据小试或中试结果进一步判定投加量。此外,投加方式对于生物强化效果也有显著影响[22]。工业规模试验中,单次投加并不能持续较长时间[23]。因此,建议采取间歇定时多次流加的方式,更利于恢复或强化硝化系统。
在工业规模硝化系统恢复调控过程中,硝化菌环境影响因子(如营养、pH、DO、温度和盐度等)均需进行合理调控[24-27],这是硝化系统性能恢复的重要前提。除维持正常的调控参数外,准确识别进水中潜在的抑制物至关重要,然后应最大限度地降低进水中抑制物浓度。同时,应设置调节池或缓冲池,尽量避免水量或水质冲击。此外,可以采取定期流加高活性硝化菌的措施,提高硝化系统运行的稳定性和耐冲击能力。
3 结 论
针对受到长期抑制且常规调控方式难以恢复的工业规模硝化系统,本文采用菌群流加恢复策略进行了小试和工业规模试验。通过长期的运行调控成功恢复了工业规模硝化系统的硝化性能,同时对工业规模硝化系统抑制后生物强化恢复策略的可行性进行了验证。通过总结分析可得出如下结论:
1)通过降低硝化系统进水中总酚浓度(<10 mg/L),在常规恢复调控方法的基础上采用菌群流加策略能够实现硝化系统的快速恢复。
2)小试较难准确识别低浓度抑制物浓度的影响及其存在的潜在风险,仅能作为工业规模硝化系统恢复可行性的初步参考,建议进行中试验证。
3)工业规模试验相比小试受到更多因素的影响,如菌群流加方式、菌群投加量、温度、溶解氧和进水负荷等,使得工业规模硝化系统的恢复调控更加复杂,准确识别硝化系统的失稳原因或抑制物种类是实现工业规模硝化系统快速恢复的关键。
[1] TANG H L, CHEN H P. Nitrification at full-scale municipal wastewater treatment plants: evaluation of inhibition and bioaugmentation of nitrifiers[J].Bioresource Technology,2015,190:76-81.
[2] HUANG Z S, LIU D S, ZHAO H X, et al. Performance and microbial community of aerobic dynamic membrane bioreactor enhanced by Cd(Ⅱ)-accumulating bacterium in Cd(Ⅱ)-containing wastewater treatment[J].Chemical Engineering Journal,2017,317:368-375.
[3] HERRERO M, STUCKEY D C. Bioaugmentation and its application in wastewater treatment: a review[J].Chemosphere,2015,140:119-128.
[4] TALE V P, MAKI J S, ZITOMER D H. Bioaugmentation of overloaded anaerobic digesters restores function and archaeal community[J].Water Research,2015,70:138-147.
[5] GUO J B, WANG J H, CUI D, et al. Application of bioaugmentation in the rapid start-up and stable operation of biological processes for municipal wastewater treatment at low temperatures[J].Bioresource Technology,2010,101(17):6622-6629.
[6] YANG K, JI B, WANG H Y, et al. Bio-augmentation as a tool for improving the modified sequencing batch biofilm reactor[J].Journal of Bioscience and Bioengineering,2014,117(6):763-768.
[7] ZHANG Q Q, YANG G F, ZHANG L, et al. Bioaugmentation as a useful strategy for performance enhancement in biological wastewater treatment undergoing different stresses: application and mechanisms [J]. Critical Reviews in Environmental Science and Technology, 2017,47(19): 1877-1899.
[8] JIN R C, ZHANG Q Q, ZHANG Z Z, et al. Bio-augmentation for mitigating the impact of transient oxytetracycline shock on anaerobic ammonium oxidation (ANAMMOX) performance[J].Bioresource Technology,2014,163:244-253.
[9] ZHANG Q Q, YANG G F, SUN K K, et al. Insights into the effects of bio-augmentation on the granule-based anammox process under continuous oxytetracycline stress: performance and microflora structure [J].Chemical Engineering Journal,2018,348:503-513.
[10] YAO H, LI H Y, XU J, et al. Inhibitive effects of chlortetracycline on performance of the nitritation-anaerobic ammonium oxidation (anammox) process and strategies for recovery [J]. Journal of Environmental Sciences,2018,70(8):29-36.
[11] CHEN Q, NI J R, MA T, et al. Bioaugmentation treatment of municipal wastewater with heterotrophic-aerobic nitrogen removal bacteria in a pilot-scale SBR[J].Bioresource Technology,2015,183:25-32.
[12] APHA, 2005.Standard Methods for the Examination of Water and Wastewater,twenty-first ed[S]. American Public Health Association,Washington,DC.
[13] 魏继林,彭党聪,聂玲,等.硝化菌添加强化硝化实验研究[J].水处理技术,2014,40(7):111-115.
[14] SALEM S, BERENDS D H J G, HEIJNEN J J,et al. Bioaugmentation by nitrification with return sludge [J].Water Research,2003,37(8):1794-1804.
[15] 张姿,汤兵.活性污泥系统中微生物菌群及其功能特性的研究进展[J].工业水处理,2015,35(3): 5-9.
[16] DENYER S P, STEWART G S A B. Mechanisms of action of disinfectants [J]. International Biodeterioration & Biodegradation, 1998, 41(98): 261-268.
[17] 李娟英,赵庆祥,江敏.氨氮生物硝化过程中苯酚的抑制作用[J].水处理技术,2007,33(2):46-49.
[18] 周振, 唐建国, 张爱平,等. 城镇污水处理厂强化硝化技术现状分析 [J]. 中国给水排水, 2013, 29(20): 5-8.
[19] BOUCHEZ T,PATUREAU D,DABERT P,et al. Ecological study of a bioaugmentation failure [J]. Environmental Microbiology, 2000, 2(2): 179-190.
[20] DILRIKA H, ABEYSINGHE D G, VIRAJ DE SILVA, et al. The effectiveness of bioaugmentation in nitrifying systems stressed by a washout condition and cold temperature[J]. Water Environment Research,2002,74(2):187-199.
[21] TAN W B, HUANG C, CHEN C, et al. Bioaugmentation of activated sludge with elemental sulfur producing strain Thiopseudomonas denitrificans X2 against nitrate shock load[J]. Bioresource Technology,2016,220:647-650.
[22] CARRERA J, MART N-HERN
N-HERN NDEZ M, SU
NDEZ M, SU REZ-OJEDA M E. Bioaugmentation for treating transient or continuous p-nitrophenol shock loads in an aerobic sequencing batch reactor[J]. Bioresource Technology, 2012,123:150-156.
REZ-OJEDA M E. Bioaugmentation for treating transient or continuous p-nitrophenol shock loads in an aerobic sequencing batch reactor[J]. Bioresource Technology, 2012,123:150-156.
[23] YU F B, ALI S W, GUAN L B, et al. Bioaugmentation of a sequencing batch reactor with Pseudomonas putida ONBA-17, and its impact on reactor bacterial communities[J].Journal of Hazardous Materials,2010,176(1/2/3):20-26.
[24] GU S B, WANG S Y, YANG Q, et al. Start up partial nitrification at low temperature with a real-time control strategy based on blower frequency and pH[J].Bioresource Technology,2012,112:34-41.
[25] ZHANG S F, WANG Y Y, HE W T, et al. Impacts of temperature and nitrifying community on nitrification kinetics in a moving-bed biofilm reactor treating polluted raw water[J]. Chemical Engineering Journal,2014,236:242-250.
[26] COLIN M F, PAMELA C, OSHLAG J Z, et al. Ammonia-oxidizing microbial communities in reactors with efficient nitrification at low-dissolved oxygen[J]. Water Research,2015,70:38-51.
[27] 刘振, 徐常青. 强化硝化工艺在污水处理中的应用 [J]. 环境工程, 2016, 34(增刊1): 135-137.