0 引 言
随着核工业的快速发展,铀矿山、铀冶炼厂、核电站等设施在运行过程中都会产生一定含铀放射性废物[1]。铀矿采、选、冶产生的废石和尾矿砂,虽然放射性活度不高,但由于规模大、数量多,且多以尾矿库的形式露天存放,在降水等淋滤作用下,尾矿库中放射性核素易渗入浅层地下水中,对尾矿库附近环境构成严重影响。在放射性核素随着水流渗透与地下水形成共迁移时,土壤胶体在放射性核素吸附后形成共同迁移,阻止放射性核素与水流继续渗入,这是现阶段对放射性核素迁移的关注重点[2,3]。
放射性核素在被土壤黏粒和有机质吸附后,在一般情况下移动性很弱,主要分布在土壤表层,对地下水污染风险很小。但近年来的研究表明,部分地区中土壤放射性核素的迁移速率明显加快,在土层中迁移深度远大于理论预测值[4]。在土壤中存在大量粒径为1~2 μm的土壤和矿质胶体,胶体能够有效地吸附环境中的污染物[5,6],并以水相的速率在环境中扩散迁移,在物理化学条件适宜时,污染物将从土壤中重新释放出来,增强污染物在地下环境中的迁移扩散能力[7-9]。
目前,土壤胶体与重金属协同迁移作用逐渐受到关注,Barton等[10]、刘冠男等[11]总结了土壤胶体对重金属运移行为的影响,提出现阶段对土壤胶体与重金属复合迁移中存在的不足;方良等[12]在建立铀尾矿库地下水污染风险评价时对土壤介质权重进行评估,建立了较为可行的风险评估方法。在国内对金属迁移的研究中,温华[13]研究了土壤矿质胶体对二价镉的吸附迁移过程,发现矿质胶体对二价镉有着很好的吸附效果,但是一旦外界环境发生改变,低能位镉离子容易重新释放到外界环境中;王明铭等[14]对重金属在沉积物中的赋存形态和迁移转化进行了研究,提出了多种存在形态以及重金属释放的影响因素;王丰雨[15]在优先流作用下进行了胶体-Pb共迁移实验,得出土壤胶体-Pb的复合共迁移能力是无胶体无优先流时的1.9倍;He等[16]在不同土壤介质时对尾矿坝中重金属的迁移进行了数值模拟,随着地下水的渗入,重金属污染可以在5年内迁移至地下45 m深处;Kanmani等[17]对露天固体废物处置场的土壤样品进行了重金属迁移研究,土壤样品中重金属浓度最大为Mn,其次分别是Pb、Cu、Cd。国内外的研究主要聚焦于对常见重金属的迁移分析,对于土壤胶体与放射性核素形成的协同迁移过程的研究较少。本文以南方某铀矿尾矿库周围稻田土壤为对象,研究了土壤不同组分对溶液中U(Ⅵ)的吸附性能,初步了解土壤胶体与U(Ⅵ)作用机理,为进一步研究土壤中放射性核素与胶体协同迁移规律提供参考。
1 实验部分
1.1 实验试剂与仪器
过氧化氢、稀盐酸:西陇化工股份有限公司;氯乙酸:山东西亚化学有限公司;2,4-硝基苯酚:国药集团化学股份有限公司;偶氮胂Ⅲ:天津市永大化学试剂有限公司;八氧化三铀:核工业北京化工研究院;以上药品均为分析纯。
pHS-3C型实验室pH计:上海智光仪器仪表有限公司;CP124C型电子天平:上海奥斯豪仪器有限公司;TDL-48B离心机:上海安亭科学仪器厂;723C分光光度计:上海新茂仪器有限公司;BELSORP minⅡ型BET分析仪:日本麦奇克拜尔有限公司;Stabino Particle Metrix颗粒电位滴定及粒度分析仪:德国Particle Metrix有限公司;SHZ-82A水浴恒温振荡器:常州市金坛友联仪器研究所。
U(Ⅵ)标准液配制:精确称取0.1179 g U3O8于50 mL烧杯中,加入10 mL王水,在电炉上加热溶解至蒸干。冷却后用pH<2的硝酸溶解定容至100 mL摇匀,配制质量浓度为1 g/L的标铀储备液。
1.2 土壤胶体的制备
实验土壤采于某铀尾矿库稻田表层15~20 cm处土壤,在105 ℃烘干过200目筛处理后。以斯托克斯定律(Stoke′s law)为基础,采用传统的虹吸法(GB 7872—1987《森林土壤黏粉的提取》)进行胶体的提取[18]。向土壤胶体中加入H2O2吸附有机质,制成矿质胶体备用。具体步骤参考土壤连续提取法[19,20]。离心收集<2 μm胶体溶液,在60 ℃左右的烘箱中烘干后研磨过200目筛备用,实验过程所需胶体量均以干重衡量。
1.3 BET比表面积测试
比表面积的测定采用BET测试法,测试仪器为BELSORP minⅡ分析仪,采用低温氮吸附法测定样品的氮气吸附-脱附等温曲线,最后运用BET理论和BJH法分析样品的比表面积、孔径和孔径分布[21,22]。
1.4 Zeta电位表征
Zeta电位分析的测量原理为Zeta流动电位,通过电位滴定直接测量界面电位,测试仪器为Stabino_Particle Metrix颗粒电位滴定及粒度分析仪,测定样品的Zeta电位-pH曲线,分析样品电负性,探究胶体样品絮凝或分散性能。
1.5 吸附实验
准确称取一定质量原土、土壤胶体和矿质胶体于锥形瓶中,加入20 mL质量浓度为10 mg/L的U(Ⅵ)溶液,用HNO3或NaOH调节溶液pH,在水浴恒温振荡器中振荡一定时间后将样品取出,置于离心机中在4000 r/min下离心2 min,取上层清液用分光光度法[23]测量溶液中剩余U(Ⅵ)的浓度,并按照式(1)和式(2)计算铀的吸附率R和t时刻的吸附容量Qt。
![]()
(1)
![]()
(2)
式中:R为吸附率,%;Qt为t时刻样品对U(Ⅵ)的吸附量,mg/g;C0为铀初始浓度,mg/L;Ct为t时刻铀的浓度,mg/L;V为体积,L;m为样品投加量,mg。
2 结果与讨论
2.1 各组分样品的比表面积分析
吸附-脱附等温曲线可反映材料的表面性质、孔隙结构和吸附质与吸附剂之间相互作用等信息,有助于描述和分析样品的比表面积和孔隙结构[24],根据IUPAC对孔径的定义,<2 nm为微孔,2~50 nm为介孔,>50 nm为大孔。
图1为土壤、矿质胶体、土壤胶体样品的氮气吸附-脱附等温曲线。其中,Va是样品单位质量的吸附-脱附量(cm3/g),p、p0分别是氮气的平衡压力和液氮温度时饱和蒸气压,p/p0是相对压力。

![]() —吸附;
—吸附; ![]() —脱附。
—脱附。
图1 土壤、矿质胶体、土壤胶体的氮气吸附-脱附等温曲线
Figure 1 Nitrogen adsorption-desorption isotherm curves of soil, mineral colloid and soil colloid
从图1可以看出,3种样品吸附等温曲线随着p/p0的增大而上升,在0.02~0.8阶段时缓慢上升,在p/p0为0.8时开始快速上升,最后达到平衡吸附量。在相对压力为0.02~0.8时,由于样品产生毛细凝聚使得等温曲线上升较为缓慢。在相对压力为0.8~1时,由于吸附剂存在着大孔径的孔隙,吸附剂之间的相互作用很强,继续吸附形成多分子层,吸附等温线快速上升。
从吸附-脱附等温曲线整体来看,该曲线属于IUPAC分类的第Ⅳ型吸附等温曲线。在低压时等温线类似于非多孔体的Ⅱ型,但在饱和蒸气压附近吸附等温线渐渐接近饱和蒸气压,因为孔内吸附膜被吸附质液体润湿,大孔内发生毛细管凝聚。图1中3种样品的吸附与脱附等温曲线不完全重合,形式表现为H3型回滞环[25],且脱附等温曲线在上方。毛细管凝聚,管壁上已经吸附一层氮气,所以在相同p/p0处脱附等温曲线的脱附量均大于吸附等温曲线。
BET理论是从经典统计理论导出的多分子层吸附理论模型[26],适合于化学性质均匀的表面,表面吸附相互作用强于吸附质间的相互作用,但弱于Langmuir理论中的活性吸附位的相互作用。
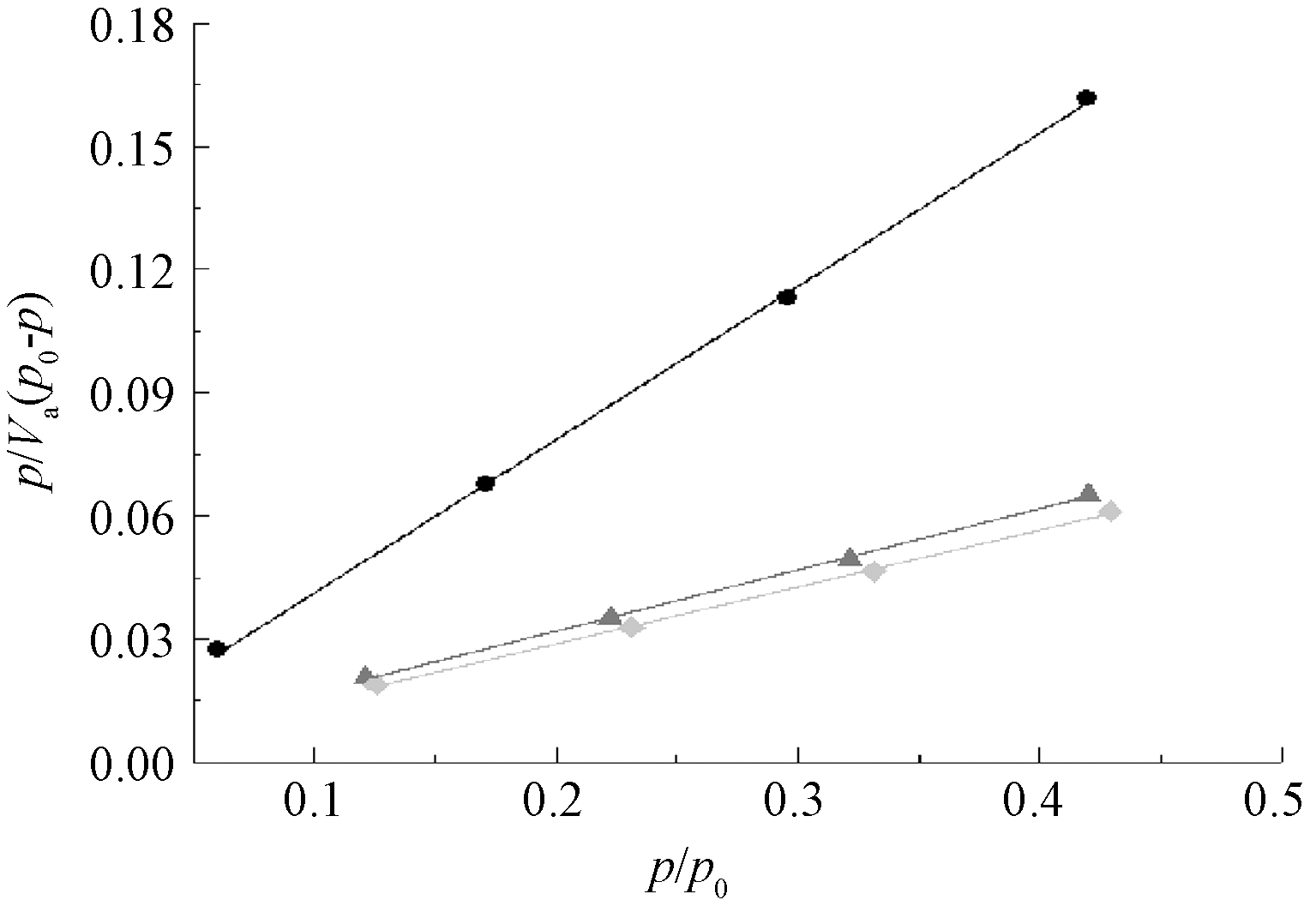
p/p0在0.05~0.35内易建立多分子层吸附。取吸附等温线上的前4个点,以p/p0为横坐标,p/Va(p0-p)为纵坐标拟合作图见图2,所得的测量结果如表1所示。
![]() —土壤BET曲线拟合;
—土壤BET曲线拟合; ![]() —矿质胶体BET曲线拟合;
—矿质胶体BET曲线拟合; ![]() —土壤胶体BET曲线拟合。
—土壤胶体BET曲线拟合。
图2 土壤、矿质胶体、土壤胶体的BET理论拟合直线
Figure 2 BET fitting straight line of soil, mineral colloid and soil colloid
从表1中C值以及各样品的比表面积可知:3种样品均为氧化物材料,孔径为17~19 nm属于介孔材料。C值由吸附剂的吸附能力决定,其吸附能力越高,其值越大,样品的吸附能力顺序为土壤胶体>土壤>矿质胶体。
表1 土壤、矿质胶体、土壤胶体的比表面积和总孔参数
Table 1 Specific surface area and total pore parameters of soil, mineral colloid and soil colloid

样品Vm/(cm3/g)CSBET/(m2/g)Vp/(cm3/g)D/nm土壤2.65395.25911.5460.05418.763矿质胶体6.61369.82728.7830.12617.802土壤胶体7.157124.6831.1490.13617.402
注:Vm为单分子层饱和吸附量(cm3/g);C为与第一吸附热和凝聚热有关的常数。SBET为样品的比表面积;Vp为总孔体积(本文中3种样品分别取p/p0为0.983、0.979、0.985处);D为平均孔径。
2.2 Zeta电位表征分析
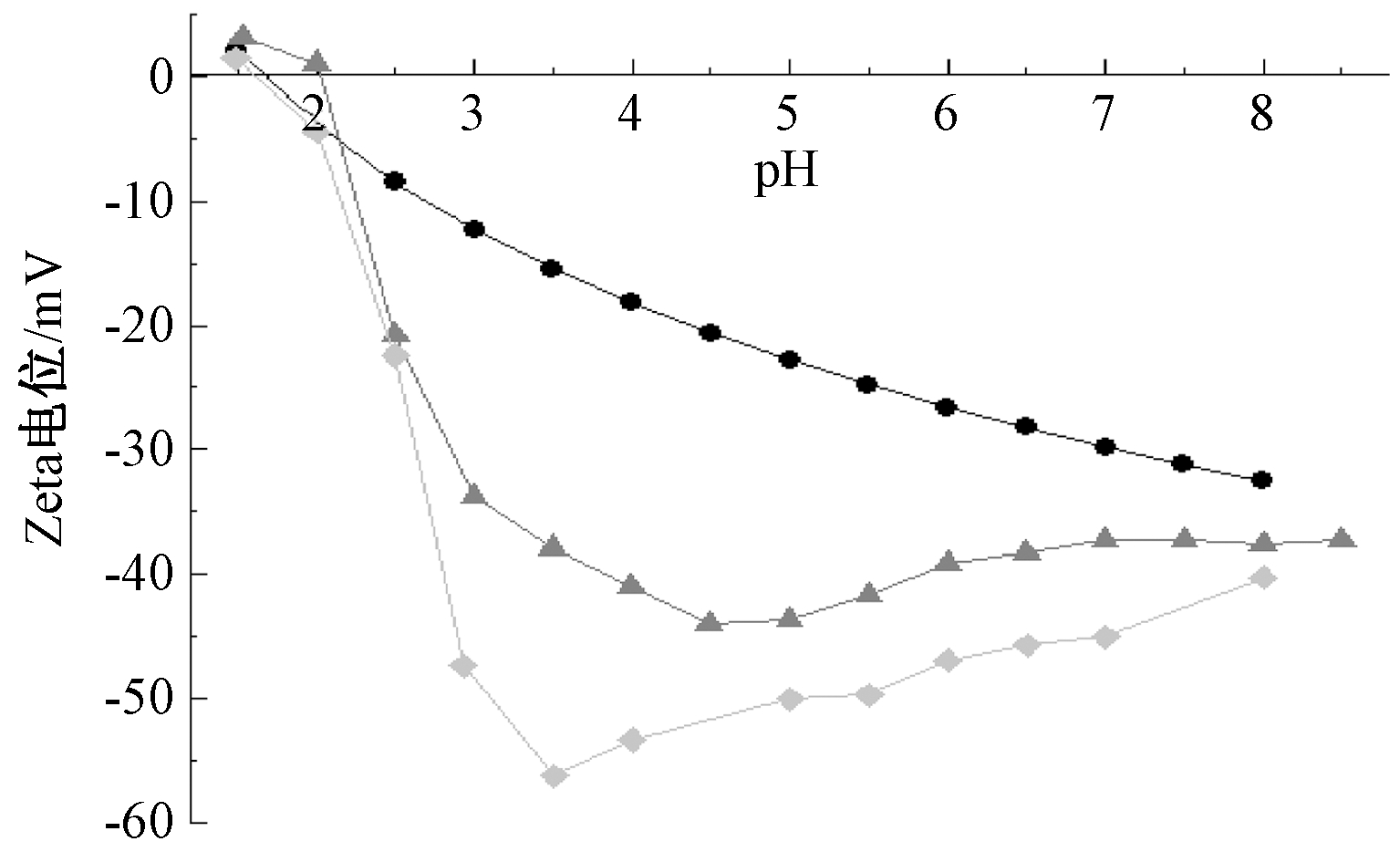
Zeta电位是反应胶体电荷特性和分散稳定性的重要指标[27],粒子表面电荷基团的微小变化都会引起Zeta电位和胶态分散稳定性的改变[28]。Zeta电位在0~±5时,胶体会快速凝结或凝聚;±10~±30时,胶体开始变得不稳定;±30~±40时,胶体稳定性一般;±40~±60时,胶体有着较好的稳定性;超过±61,胶体稳定性极好[29]。
由图3土壤、矿质胶体、土壤胶体的Zeta电位与pH的变化关系可看出:土壤和土壤胶体其等电位(IEP)位于pH=1.6附近,而矿质胶体的等电位位于pH=2附近,在pH低于或高于等电点位时,土壤和土壤胶体颗粒表面分别带正电和负电。土壤中的有机质、氧化物、氢氧化物等表面,以及层状硅酸盐矿物的断键边面的功能基团都是羟基(M—OH,M代表各种阳离子),该功能团通过吸附N+或者OH-发生质子化或脱质子,从而使表面电荷发生变化[30]。在pH较小时,各样品表面基团大多以![]() 的形式存在,Zeta电位绝对值较小;随着pH的增大,样品溶液中H+浓度逐渐减小,样品表面M—OH逐渐形成,表面电位绝对值减小;当pH接近等电位时,表面电位接近零,几乎所有的表面及断键边面可变电荷都以M—OH存在。最终,随着pH的增大M—OH脱质子后生成M—O-,表面电位变为负值,并随着pH的增大而减小。总体上,3种样品的Zeta电位绝对值均随着pH的增大而增大,矿质胶体和土壤胶体在pH分别为4.5和3.5时,样品颗粒表面的Zeta电位绝对值有降低趋势。根据DLVO理论[31,32],这是因调节pH时引入过多的酸碱而使溶液中盐离子浓度增加,颗粒表面的双电子层被压缩而引起的。
的形式存在,Zeta电位绝对值较小;随着pH的增大,样品溶液中H+浓度逐渐减小,样品表面M—OH逐渐形成,表面电位绝对值减小;当pH接近等电位时,表面电位接近零,几乎所有的表面及断键边面可变电荷都以M—OH存在。最终,随着pH的增大M—OH脱质子后生成M—O-,表面电位变为负值,并随着pH的增大而减小。总体上,3种样品的Zeta电位绝对值均随着pH的增大而增大,矿质胶体和土壤胶体在pH分别为4.5和3.5时,样品颗粒表面的Zeta电位绝对值有降低趋势。根据DLVO理论[31,32],这是因调节pH时引入过多的酸碱而使溶液中盐离子浓度增加,颗粒表面的双电子层被压缩而引起的。
![]() —土壤;
—土壤; ![]() —矿质胶体;
—矿质胶体; ![]() —土壤胶体。
—土壤胶体。
图3 土壤、矿质胶体、土壤胶体的Zeta电位与pH的变化关系
Figure 3 Relationship between zeta potential and pH of soil, mineral colloid and soil colloid
2.3 不同因素对U(Ⅵ)吸附的影响
2.3.1 溶液pH
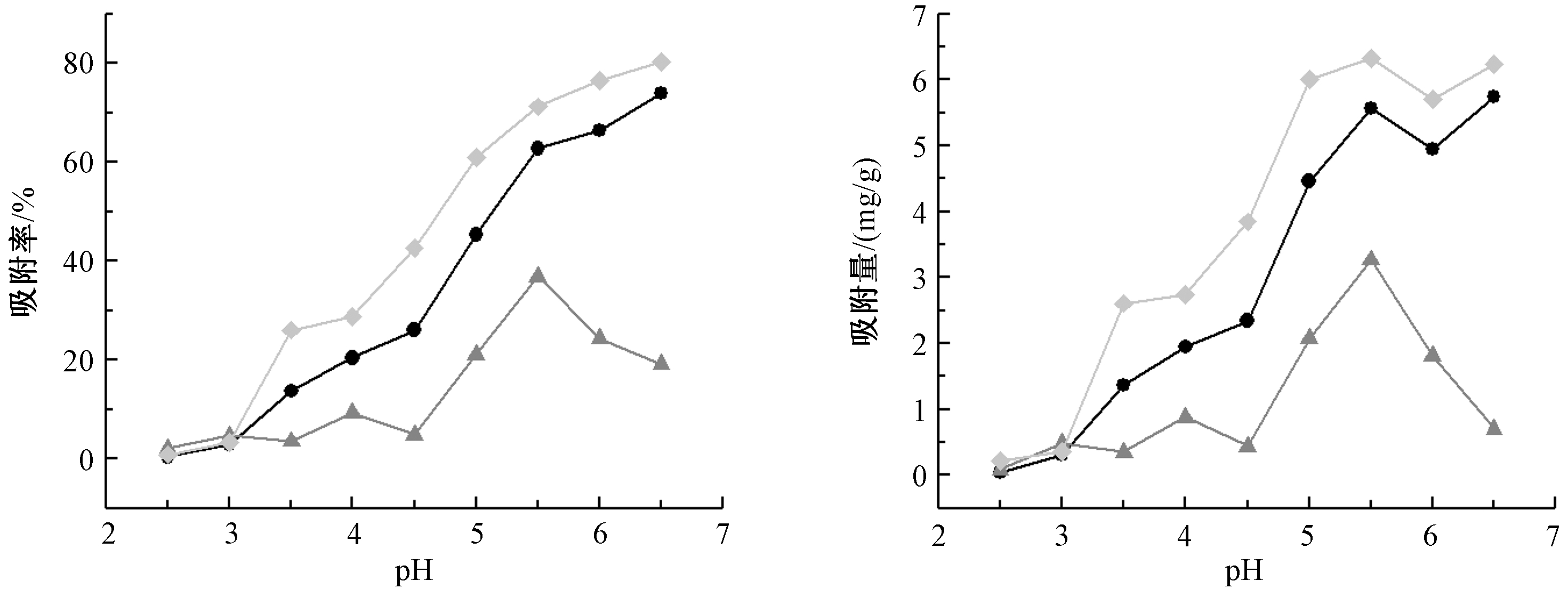
在固液比为1.0 g/L,U(Ⅵ)质量浓度为10.0 mg/L,反应时间为2 h,温度为25 ℃的条件下,溶液pH对各样品吸附U(Ⅵ)的影响如图4所示。
![]() —土壤;
—土壤; ![]() —矿质胶体;
—矿质胶体; ![]() —土壤胶体。
—土壤胶体。
图4 溶液pH对各组分样品吸附U(Ⅵ)效果的影响
Figure 4 Effect of initial solution pH on adsorption of U(Ⅵ) on different samples
由图4可看出:在溶液pH较低的情况下,所有样品对U(Ⅵ)几乎没有吸附;随着pH的升高,各样品的吸附率开始增加;在pH=5.5时,矿质胶体的吸附率和吸附量达到最大值。3种样品的吸附率和吸附量顺序均为:土壤胶体>土壤>矿质胶体。由于所采土壤样品pH值为5.02,同时铀的提取主要为酸法浸出,渗滤液也主要为偏酸性环境,根据铀在不同pH溶液中的存在形态[33],铀在溶液pH=5.5时主要以![]() 形式存在,
形式存在,![]() 浓度占比仅为6.47%,随着pH的升高,
浓度占比仅为6.47%,随着pH的升高,![]() 不断水解。因此本实验只考虑了在pH<6.5的酸性环境中样品对U(Ⅵ)的吸附性能。
不断水解。因此本实验只考虑了在pH<6.5的酸性环境中样品对U(Ⅵ)的吸附性能。
通过对土壤的矿物成分分析,所采土壤样品主要成分为2∶1型蒙脱石、高岭土及石英等氧化物和硅酸盐。同时在酸性条件下,U(Ⅵ)在溶液中主要以![]() 的形态存在,从所有组分样品的Zeta电位表征中可知,在酸性条件下所有样品表面电荷为负电,溶液中主要发生如下作用:
的形态存在,从所有组分样品的Zeta电位表征中可知,在酸性条件下所有样品表面电荷为负电,溶液中主要发生如下作用:
1) 絮凝沉淀作用。从Zeta电位表征分析可知,土壤胶体和矿质胶体在溶液中电性为负。此时,加入阳离子![]() 溶液会使得胶体粒子与
溶液会使得胶体粒子与![]() 相互吸引,中和胶粒所带电荷,使溶液中的胶体稳定性下降,产生絮凝沉淀。
相互吸引,中和胶粒所带电荷,使溶液中的胶体稳定性下降,产生絮凝沉淀。
2)竞争吸附作用。大多数氧化物矿物表面吸附反应可视为表面络合反应,![]() 在矿物表面的位点发生络合反应形成络合物被吸附[34],同时溶液中H+也会与矿物表面的位点产生反应,两者形成竞争关系。其反应式如下[35]:
在矿物表面的位点发生络合反应形成络合物被吸附[34],同时溶液中H+也会与矿物表面的位点产生反应,两者形成竞争关系。其反应式如下[35]:
![]()
(3)
RO-+H+⟺ROH
(4)
pH越低,溶液中的H+浓度越高,与各组分样品表面活性位点发生结合的概率越大,吸附效果越差。随着pH增大,溶液中H+浓度下降,与![]() 及水解产物
及水解产物![]() 和
和![]() 等的竞争减小。这些带正电阳离子会与各组分样品的表面位点继续发生络合反应。在pH>5.5时,矿质胶体的吸附率急剧下降,主要原因是溶液中UO2(OH)+进一步水解形成UO2(OH)2·H2O,同时产生的
等的竞争减小。这些带正电阳离子会与各组分样品的表面位点继续发生络合反应。在pH>5.5时,矿质胶体的吸附率急剧下降,主要原因是溶液中UO2(OH)+进一步水解形成UO2(OH)2·H2O,同时产生的![]() 与溶液中
与溶液中![]() 络合生成不易吸附的络合阴离子,从而使矿质胶体样对U(Ⅵ)吸附率下降。
络合生成不易吸附的络合阴离子,从而使矿质胶体样对U(Ⅵ)吸附率下降。
2.3.2 反应时间
在溶液pH=5.5,固液比为1.0 g/L,ρ(U(Ⅵ))为10.0 mg/L,温度为25 ℃的条件下,各样品在不同反应时间对溶液中U(Ⅵ)的吸附量如图5所示。

![]() —土壤;
—土壤; ![]() —矿质胶体;
—矿质胶体; ![]() —土壤胶体。
—土壤胶体。
图5 反应时间对各组分样品吸附U(Ⅵ)效果的影响
Figure 5 Effect of reaction time on adsorption of U(Ⅵ) on different samples
从图5可以看出:在40 min之前,各样品对U(Ⅵ)的吸附速率较快,吸附量急剧上升。土壤和土壤胶体在50 min时达到吸附率和吸附量的最大值,而矿质胶体在40 min时达到最大值。随着反应时间的增加,各样品的吸附率和吸附量开始缓慢下降直至平衡。在反应开始阶段,溶液中存在絮凝沉淀以及竞争吸附等主要作用。随着反应的进行,各样品表面的吸附位点开始与U发生表面络合反应,同时样品水解产物Na+、K+等阳离子与![]() 发生离子交换[34]。随着反应时间的增加,(RO)2UO2的水解速度大于其生成速度,水解产物RO-被溶液
发生离子交换[34]。随着反应时间的增加,(RO)2UO2的水解速度大于其生成速度,水解产物RO-被溶液![]() 等阳离子竞争吸附,U(Ⅵ)的吸附率开始下降并逐渐稳定。
等阳离子竞争吸附,U(Ⅵ)的吸附率开始下降并逐渐稳定。
2.3.3 U(Ⅵ)初始浓度
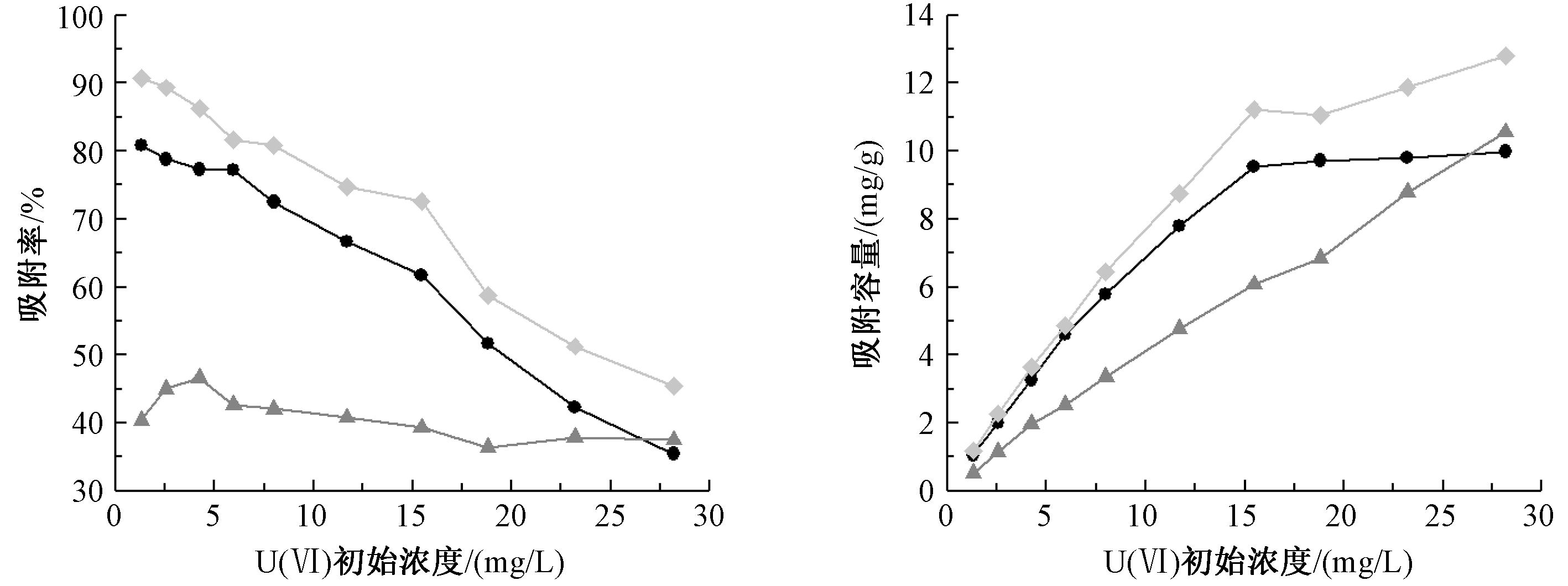
在溶液pH=5.5,固液比为1.0 g/L,土壤和土壤胶体反应时间为50 min,矿质胶体反应时间为40 min,温度为25 ℃的条件下,U(Ⅵ)初始浓度对各组分样品吸附U(Ⅵ)效果如图6所示。
由图6可知:随着U(Ⅵ)初始质量浓度的升高,土壤和矿质胶体的吸附率逐渐下降。吸附容量逐渐上升,在U(Ⅵ)初始质量浓度在15 mg/L之前,吸附量呈线性增长;当质量浓度>15 mg/L时,吸附量缓慢增加直至平衡,吸附率快速下降。随着初始浓度的增加,各样品表面位点与![]() 离子接触机会增加,吸附量不断增加。在初始浓度较低时,各组分样品表面的活性吸附位点多于溶液中
离子接触机会增加,吸附量不断增加。在初始浓度较低时,各组分样品表面的活性吸附位点多于溶液中![]() 随着浓度的增加,土壤以及土壤胶体表面位点在不断消耗,其吸附量始终较矿质胶体更大,土壤和土壤胶体在反应中还存在有机质中—OH、—C
随着浓度的增加,土壤以及土壤胶体表面位点在不断消耗,其吸附量始终较矿质胶体更大,土壤和土壤胶体在反应中还存在有机质中—OH、—C![]() O、—C—H、—NH2等主要吸附位点[36]。对于矿质胶体,在初始浓度达到4 mg/L之后,各组分样品的吸附率开始逐渐下降并达到平衡,各样品的吸附容量不断增加,矿质胶体在与
O、—C—H、—NH2等主要吸附位点[36]。对于矿质胶体,在初始浓度达到4 mg/L之后,各组分样品的吸附率开始逐渐下降并达到平衡,各样品的吸附容量不断增加,矿质胶体在与![]() 吸附的过程中同时进行着脱附过程,当吸附过程与脱附过程达到平衡后,随着初始浓度的不断增加,吸附与脱附一直处于平衡状态,吸附量也随着初始浓度的增大而增大。
吸附的过程中同时进行着脱附过程,当吸附过程与脱附过程达到平衡后,随着初始浓度的不断增加,吸附与脱附一直处于平衡状态,吸附量也随着初始浓度的增大而增大。
![]() —土壤;
—土壤; ![]() —矿质胶体;
—矿质胶体; ![]() —土壤胶体。
—土壤胶体。
图6 U(Ⅵ)初始浓度对各组分样品吸附U(Ⅵ)效果的影响
Figure 6 Effect of different U(Ⅵ) initial concentrations on adsorption of U(Ⅵ) on different samples
3 结 论
1) 土壤、土壤胶体对U(Ⅵ)有着较好的吸附效果,当溶液pH=5.5,固液比为1.0 g/L,土壤和土壤胶体反应时间为50 min,温度为20 ℃时,U(Ⅵ)的吸附率和吸附量分别达到76.67%、83.03%和8.53 mg/g、9.24 mg/g。矿质胶体对U(Ⅵ)的吸附性能一般,在溶液pH=5.5,固液比为1.0 g/L,反应时间为40 min,温度为20 ℃时,U(Ⅵ)的吸附率和吸附量分别达到48.87%和5.43 mg/g。
2) 土壤、矿质胶体、土壤胶体的表征结果表明,3种样品均为氧化物材料,孔径为17~19 nm,比表面积较大,有着较多的反应活性位点。样品表面双电层呈电负性,对络合阳离子有着较好的吸附效果。
3)从不同样品对铀的吸附效果可知:土壤胶体对U(Ⅵ)的吸附效果较好,而矿质胶体的吸附效果一般,且各样品吸附规律符合BET法表征中C值拟合结果。土壤胶体可以固定土壤中的U(Ⅵ),阻止放射性核素随土壤水分继续渗入,并进入地下水。
[1] 郭栋清,李静,张利波,等. 核工业含铀废水处理技术进展[J].工业水处理,2019,39(1):14-20.
[2] 董文明,杜金州,陶祖贻. 核素迁移与胶体[J].原子能科学技术,2000,34(1):93-97.
[3] 曹存存,吕俊文,夏良树,等. 土壤胶体对渗滤液中铀(Ⅵ)迁移影响的研究进展[J].核化学与放射化学,2012,34(1):1-7.
[4] 蒋经乾,劳玉军,王理,等. 铀矿山尾矿库区浅层尾砂中核素的垂直分布特征[J].环境化学,2015,34(8):1561-1563.
[5] 闫金龙,吴文丽,江韬,等. 土壤组分对磷形态和磷吸附-解吸的影响:基于三峡库区消落带落干期土壤[J].中国环境科学,2019,39(3):1124-1131.
[6] 朱丽珺.不同林分类型土壤及主要组分对重金属吸附特征研究[D].南京:南京林业大学,2007.
[7] 周皓.地下水中胶体形成机理及对污染物迁移的影响[J].西部探矿工程,2008,20(11):68-72.
[8] ZHOU D M, WANG D T, CANG L, et al. Transport and re-entrainment of soil colloids in saturated packed column: effects of pH and ionic strength [J]. Journal of Soils and Sediments, 2011, 11(3):491-503.
[9] ARAMRAK S, FLURY M, HARSH J B, et al. Colloid mobilization and transport during capillary fringe fluctuations [J]. Environmental Science & Technology, 2014, 48(13):7272-7279.
[10] BARTON C D, KARATHANASIS A D. Influence of soil colloids on the migration of atrazine and zinc through large soil monoliths [J]. Water Air & Soil Pollution, 2003, 143(1/2/3/4):3-21.
[11] 刘冠男,刘新会.土壤胶体对重金属运移行为的影响[J].环境化学,2013,32(7):1308-1317.
[12] 方良,周书葵,刘迎九,等. 铀尾矿库地下水污染风险评价方法研究[J]. 环境工程, 2016, 34(1):100-102.
[13] 温华. 三峡水库消落区土壤矿质胶体对镉的吸持特征与胶体-镉复合迁移研究[D].重庆:西南农业大学,2005.
[14] 王明铭, 丁爱中, 郑蕾,等. 沉积物金属迁移-转化的影响因素及其规律[J]. 环境工程, 2016, 34(11):150-154.
[15] 王丰雨.优先流作用下的胶体-Pb的复合共迁移研究[J]. 环境污染与防治, 2010, 32(7):66-70.
[16] HE Y, LI B B, ZHANG K N, et al. Experimental and numerical study on heavy metal contaminant migration and retention behavior of engineered barrier in tailings pond[J]. Environmental pollution (Barking, Essex: 1987),2019,252(Pt B):1010-1018.
[17] KANMANI S, GANDHIMATHI R. Assessment of heavy metal contamination in soil due to leachate migration from an open dumping site[J]. Applied Water Science, 2013, 3(1):193-205.
[18] 中国林业科学研究院. 森林土壤粘粒的提取:GB 7872—1987[S]. 北京:中国标准出版社,1987.
[19] 牟树森, 青长乐.环境土壤学[M]. 北京:中国农业出版社,1993.
[20] 熊毅.土壤胶体,第一册[M]. 北京:科学出版社,1983.
[21] 赵振国.吸附作用应用原理[M]. 北京:化学工业出版社,2005.
[22] Asmadi, Aldi, Kendrick, John, Leusen, Frank J J. Physical Chemistry Chemical Physics[M]. London: Royal Society of Chemistry, 2010.78-85.
[23] 杜浪,李玉香,马雪,等. 偶氮胂Ⅲ分光光度法测定微量铀[J]. 冶金分析, 2015, 35(1):68-71.
[24] 何余生,李忠,奚红霞,等. 气固吸附等温线的研究进展[J]. 离子交换与吸附, 2004, 20(4):376-384.
[25] 近藤精一,石川达雄,安部郁夫.吸附科学[M]. 李国希,译. 北京:化学工业出版社,2005:41-48.
[26] HILL T L. Theory of Multimolecular Adsorption from a Mixture of Gases[J]. The Journal of Chemical Physics, 2004, 14(4):268-275.
[27] SARA F, MARTINA C, VERONICA P, et al. Zeta potential measurements on solid surfaces for in vitro biomaterials testing: surface charge, reactivity upon contact with fluids and protein absorption[J]. Frontiers in Bioengineering and Biotechnology, 2018, 60(6):1-7.
[28] BASHIR S, RIZWAN M S, SALAM A, et al. Cadmium immobilization potential of rice straw-derived biochar, zeolite and rock phosphate: extraction techniques and adsorption mechanism[J]. Bulletin of Environmental Contamination and Toxicology, 2018,25(3):26-32.
[29] JOHN N, ARNEPALLI D N. Factors Influencing Zeta Potential of Clayey Soils[M]. Berlin: Geotechnical Characterisation and Geoenvironmental Engineering, 2019.
[30] 于天仁.土壤化学原理[M].北京:科学出版社,1987.
[31] PIERRE A C, MA K. DLVO theory and clay aggregate architectures formed with AlCl3[J]. Journal of the European Ceramic Society, 1999, 19(8):1615-1622.
[32] YU Y X, MA L Q, XU H X, et al. DLVO theoretical analyses between montmorillonite and fine coal under different pH and divalent cations[J]. Powder Technology, 2018, 330:147-151.
[33] 李小燕.溶液中U(Ⅵ)、Th(Ⅳ)吸附材料的制备及吸附性能和机理研究[M]. 北京:中国原子能出版社,2014.
[34] 熊正为, 王清良, 郭成林. 蒙脱石吸附铀机理实验研究[J]. 湖南师范大学自然科学学报, 2007, 30(3):75-79.
[35] 陆雅海, 黄昌勇, 袁可能,等. 砖红壤及其矿物表面对重金属离子的专性吸附研究[J]. 土壤学报, 1995(4):370-376.
[36] 张亚萍,谢水波,杨金辉,等.腐殖酸吸附水中铀的特性与机理[J].安全与环境学报,2012,12(4):66-71.