0 引 言
石油通常是指未经提炼的原油[1],具有较强的生物毒性,会通过多种方式造成土壤污染,对人类社会和自然环境构成严重威胁[2]。传统的土壤石油污染治理技术主要是一些物理、化学方法,成本较高且效率低,而原位生物修复是一种高效、经济、可行且环境友好的技术[3]。
石油污染土壤的生物修复中,温度是影响修复效率的重要因素。深层土壤的温度较低[4-5],适温微生物的生长代谢活动缓慢,降解效率受到限制[6-9]。低温微生物能以独特的生理功能适应环境,用于石油污染土壤修复,不仅技术可行,而且具有重要的理论意义和社会价值。国外已有研究发现了一些低温微生物,如诺卡氏菌属(Nocardia)[10]、假单胞菌属(Pseudoalteromonas)[11]、沙门氏菌属(Salmonella)[12]、红球菌属(Rhodococcus)[13]、争论贪噬菌(Variovorax paradoxus)[14]等菌株,对脂肪烃和多环芳烃表现出较好的降解效果。
目前,国内外采用单一菌株进行石油污染土壤的生物修复的研究报道较多,实际应用中难以达到理想的修复效果。微生物菌群的协同修复不仅能显著提高石油的降解效率,而且适用于石油污染土壤的原位修复[2]。研究发现,与单一细菌相比,以食碱菌(Alcanivora)和解环菌(Cycloclasticus)为优势菌株的土著菌群对石油表现出更高的降解率[15]。
本研究旨在探索人工构建低温石油降解菌群,在反应器中实现快速石油降解,同时通过在线监测反应器中CO2和O2的浓度变化来评价石油降解效果,探索并优化石油污染土壤原位修复的过程控制参数及条件。
1 实验部分
1.1 实验材料
样品来源:本研究中所用样品来自(121°60′N、40°47′E)的石油污染土壤,总油浓度为181.93 mg/g,主要污染物为C10—C38的正构烷烃,含量约为79.73 mg/g。
培养基:MM培养基(无碳源):MgSO4·7H2O 3.5 g/L,CaCl2 0.05 g/L,NaCl 5 g/L,KCl 0.35 g/L,(NH4)2SO4 0.5 g/L,KH2PO4 1.0 g/L,Na2HPO4 1.0 g/L,pH 7.5。MM琼脂培养基为MM基础培养基外加15 g/L琼脂。LB培养基:蛋白胨10.0 g/L,酵母浸粉5.0 g/L,NaCl 10 g/L,pH 7.5。
1.2 石油降解菌株的富集及筛选
称取5 g土壤样品于装有50 mL无菌水的250 mL三角瓶中,15 ℃,150 r/min条件下振荡7 d后,取3 mL土壤悬液加入装有含2%(w/V)原油MM培养基(30 mL)的250 mL三角瓶中,15 ℃,150 r/min条件下振荡7 d;吸取1 mL培养液加入至装有含2%(w/V)原油MM培养基(30 mL)的250 mL三角瓶中,15 ℃,150 r/min条件下振荡培养10 d,2轮重复后,取100 μL培养液,梯度稀释,涂布含2%原油的MM平皿,15 ℃培养72 h,挑取单菌落,接种LB琼脂培养基,15 ℃培养48 h,4 ℃冰箱短期保存;LB培养基的培养物接种LB液体培养基,15 ℃,150 r/min条件下培养12 h,培养液与50%的甘油1∶1混匀,冻存于-80 ℃冰箱。
1.3 菌种鉴定
用Ezup柱式细菌基因组DNA抽提试剂盒(上海生工生物工程公司)提取菌株DNA,利用细菌16S rRNA通用引物1492R(5′-GGTACCTTGTTACGACTT-3′)和27F(5′-AGAGTTTGATCCTGGCTCAG-3′)进行PCR扩增。PCR体系(50 μL):DNA模板2 μL,正反向引物各1 μL,dNTP 4 μL,10× PCR 缓冲液5 μL,Taq DNA聚合酶0.2 μL,纯水36.8 μL。PCR条件:95 ℃预变性5 min,95 ℃ 30 s、50 ℃ 30 s、72 ℃ 1.5 min 30个循环,72 ℃延伸10 min。扩增产物送至北京华大基因公司测序,结果提交至NCBI数据库。
1.4 低温细菌的石油降解特性分析
1.4.1 温度对细菌降解石油的影响
LB培养基固体培养物,PBS缓冲液洗脱,稀释至OD600=0.5。以5%的接种量接种至含1%原油MM培养基(30 mL)的250 mL三角瓶中,分别在15,25,37 ℃条件下,150 r/min振荡培养15 d,每隔12 h培养液取样进行OD600测定,每组实验设置无原油对照。
1.4.2 细菌对不同石油烃的降解能力分析
LB培养基固体培养物,PBS缓冲液洗脱,稀释至OD600=0.5,以5%的接种量接种至含2 g/L环己烷、2 g/L正十六烷或0.1 g/L菲为唯一碳源MM培养基(30 mL)的250 mL三角瓶中,15 ℃,150 r/min条件下振荡培养7 d,每隔12 h培养液取样进行OD600测定,7 d后对培养液中的残余石油烃浓度进行测定;每组实验设置无菌对照。
培养液中的残余正十六烷和环己烷分别用正己烷和二甲苯进行萃取,利用赛默飞Trace 1300气相色谱仪进行定量测定[16, 17]。培养液中的残余菲用乙酸乙酯进行萃取,利用安捷伦1290 Infinity Ⅱ高效液相色谱仪进行定量测定[16]。
1.5 低温细菌产表面活性剂能力分析
将生长对数期的菌液分别接种至含1%原油、含1%原油与0.03%鼠李糖脂的30 mL MM培养基中,15 ℃,150 r/min振荡培养15 d,每隔12 h培养液取样进行OD600测定。每组实验设置无菌对照。培养5,10,15 d后,将只含原油培养基的全部培养液转移至50 mL离心管,8000×g离心10 min,将除去菌体和原油后的中层液体转移至培养皿,用配备有25 N测力传感器的质构仪(TMS-Pilot,FTC,USA),采用圆盘探头对样品的表面张力进行测定,每个样品重复测定3次。
1.6 低温菌群的石油降解分析
采用德国SAXON Infralyt 80多组分尾气分析仪,对5 L发酵罐中低温菌群的石油降解过程中的CO2和O2浓度进行实时在线监测,以15 ℃、5 d内CO2产量和O2消耗量的动力学曲线表征菌群的石油降解能力,并对添加鼠李糖脂生物表面活性剂及25 ℃条件下的石油降解进行测定与分析,每组实验设置无菌对照。
2 结果与讨论
2.1 菌种鉴定结果
从石油污染土壤中筛选得到7株石油降解菌,可在15 ℃时,以原油为唯一碳源的培养基中良好生长。经形态学鉴定,7株细菌均为革兰氏阴性。7株细菌的16S rDNA鉴定比对结果如表1所示。
表1 7株石油降解菌鉴定结果
Table 1 Identification and contrast of seven oil-degrading bacteria strains

菌编号菌属种名相似度/%Genbank登录号JLH001节杆菌属Arthrobactersulfonivorans99MK691447JLH002不动杆菌属Acinetobacterbaumannii100MK691448JLH003假单胞菌属Pseudomonasfragi100MK691449JLH004苍白杆菌属Ochrobactrumpituitosum98MK691450JLH005不动杆菌属Acinetobactercalcoaceticus100MK691451JLH006节杆菌属Arthrobacteroxydans97.5MK691452JLH007拉恩氏菌属Rahnellaaquatilis99.93MK691453
2.2 菌株的石油降解特性
2.2.1 温度对石油降解细菌生长的影响
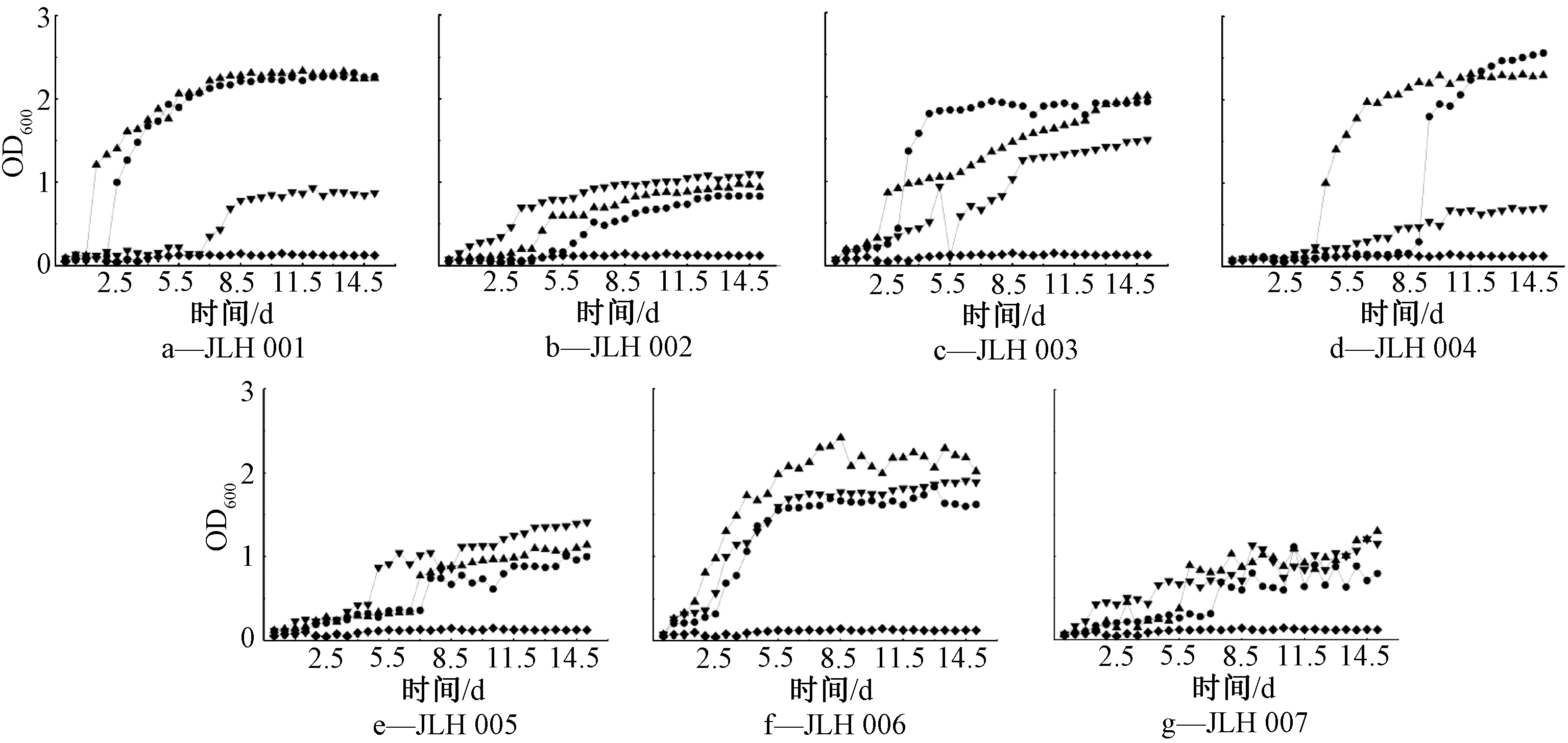
不同温度下,不同菌株在原油培养基中的生长情况如图1所示。可知:在15,25 ℃下,JLH 001、JLH 003和JLH 004菌株的生长均优于37 ℃;其余4个菌株,在15,25,37 ℃下,生长差异不大,基于微生物生长的最适温度,7株分离细菌均属于兼性嗜冷菌。
![]() —15 ℃;
—15 ℃; ![]() —25 ℃;
—25 ℃; ![]() —37 ℃;
—37 ℃; ![]() —对照。
—对照。
图1 7株细菌在1%原油培养基中不同温度下的生长曲线
Figure 1 Growth curve of seven isolated strains in 1% crude oil medium at different temperature
2.2.2 石油烃对低温细菌生长的影响
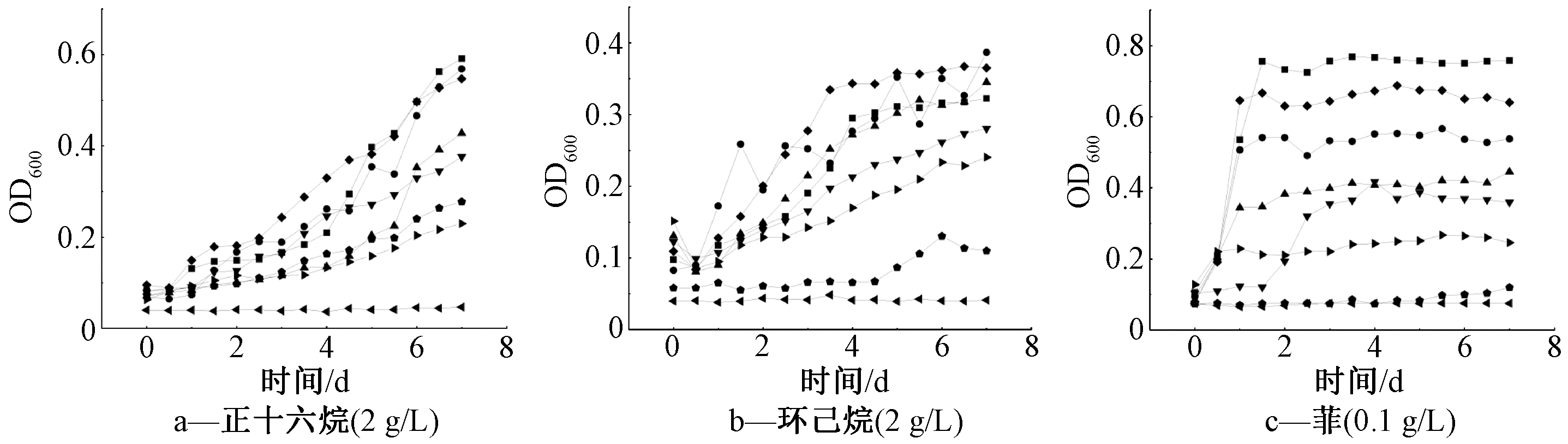
图2为7株菌株在正十六烷、环己烷、菲中的生长情况。可知:不同菌株在不同烃化合物培养基中的生长速度及生长量不同;同时,不同菌株在相同烃化合物培养基中的生长能力差异较大。菌株JLH 001、JLH 002和JLH 006以3种石油烃为碳源时生长能力均较强,而菌株JLH 007和JLH 003的生长能力相对较差。
2.2.3 低温细菌对不同石油烃的降解能力
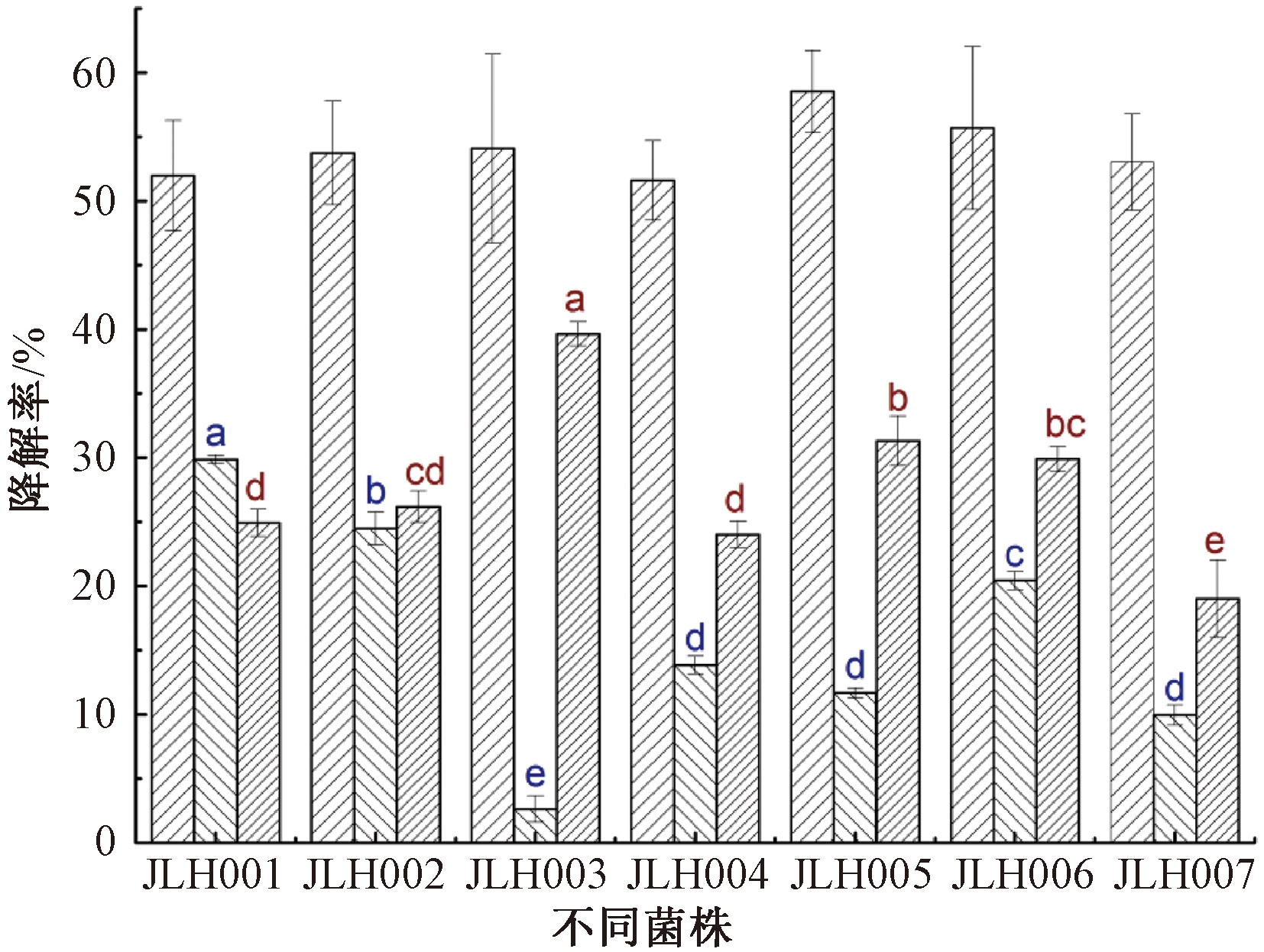
图3为7株细菌对以正十六烷、环己烷、菲作为石油烃类的代表化合物的降解情况。可知:7株细菌对环己烷的降解率在55%左右,无显著性差异。JLH 001,JLH 002和JLH 006对正十六烷的降解能力较强,降解率>20%,高于文献[18]报道的15%。JLH 003对菲的降解率达到40%;除JLH 004和JLH 007外,其余4株细菌对菲的降解率均>25%,与文献[19]报道的20%处于同一水平,比假单胞菌W12稍低[20]。
![]() —JLH 001;
—JLH 001; ![]() —JLH 002;
—JLH 002; ![]() —JLH 003;
—JLH 003; ![]() —JLH 004;
—JLH 004; ![]() —JLH 005;
—JLH 005; ![]() —JLH 006;
—JLH 006; ![]() —JLH 007;
—JLH 007; ![]() —对照。
—对照。
图2 15 ℃下7株细菌在正十六烷,环己烷和菲培养基中的生长曲线
Figure 2 Growth curve of 7 isolated strains in presence of hexadecane, cyclohexane and phenanthrene at 15 ℃
![]() 环己烷;
环己烷; ![]() 正十六烷;
正十六烷; ![]() 菲。
菲。
注:误差线表示标准差,不同字母表示不同菌株间的差异,P<0.05。
图3 7株细菌15 ℃下培养7 d对不同石油烃类的降解
Figure 3 Degradation of hexadecane, cyclohexane and phenanthrene by 7 isolated strains after incubating for seven days at 15 ℃
该结果与石油烃对分离细菌生长的影响一致,JLH 001、JLH 002与JLH 006在3种烃类培养基中生长良好,降解率也较高。
2.3 低温石油降解菌的产表面活性剂能力
2.3.1 添加表面活性剂对低温石油降解细菌生长的影响
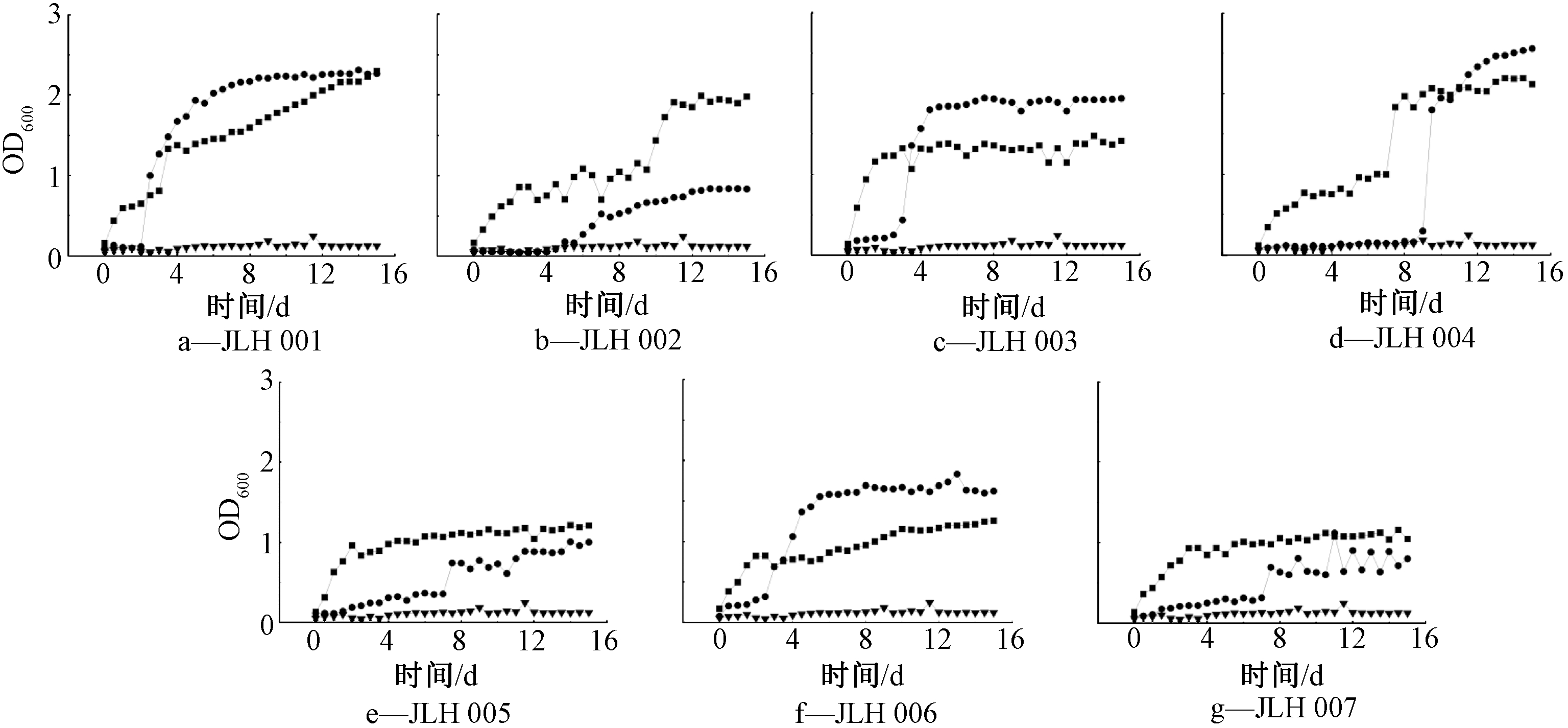
石油烃的生物可利用性是影响微生物降解石油的关键因素,而石油烃的疏水性是限制其生物可利用性的重要条件之一[21]。鼠李糖脂对不同菌株在石油中生长的影响如图4所示。可知:添加鼠李糖脂对菌株JLH 001、JLH 003和JLH 006的生长影响较小,延迟期有利于菌体的生长,平衡期降低了菌株生长量,这与文献报道一致,即一定浓度的鼠李糖脂会对假单胞菌CICC 20575吸收正十六烷产生抑制作用[22]。其余4株细菌,添加鼠李糖脂对其生长均表现出明显的促进作用。
![]() —外加鼠李糖脂;
—外加鼠李糖脂; ![]() —未加鼠李糖脂;
—未加鼠李糖脂; ![]() —对照。
—对照。
图4 15 ℃下添加鼠李糖脂对7株细菌在1%原油培养基中生长的影响
Figure 4 Effects of adding rhamnolipid on growth of 7 isolated strains in 1% crude oil media at 15 ℃
2.3.2 低温细菌培养液表面张力变化
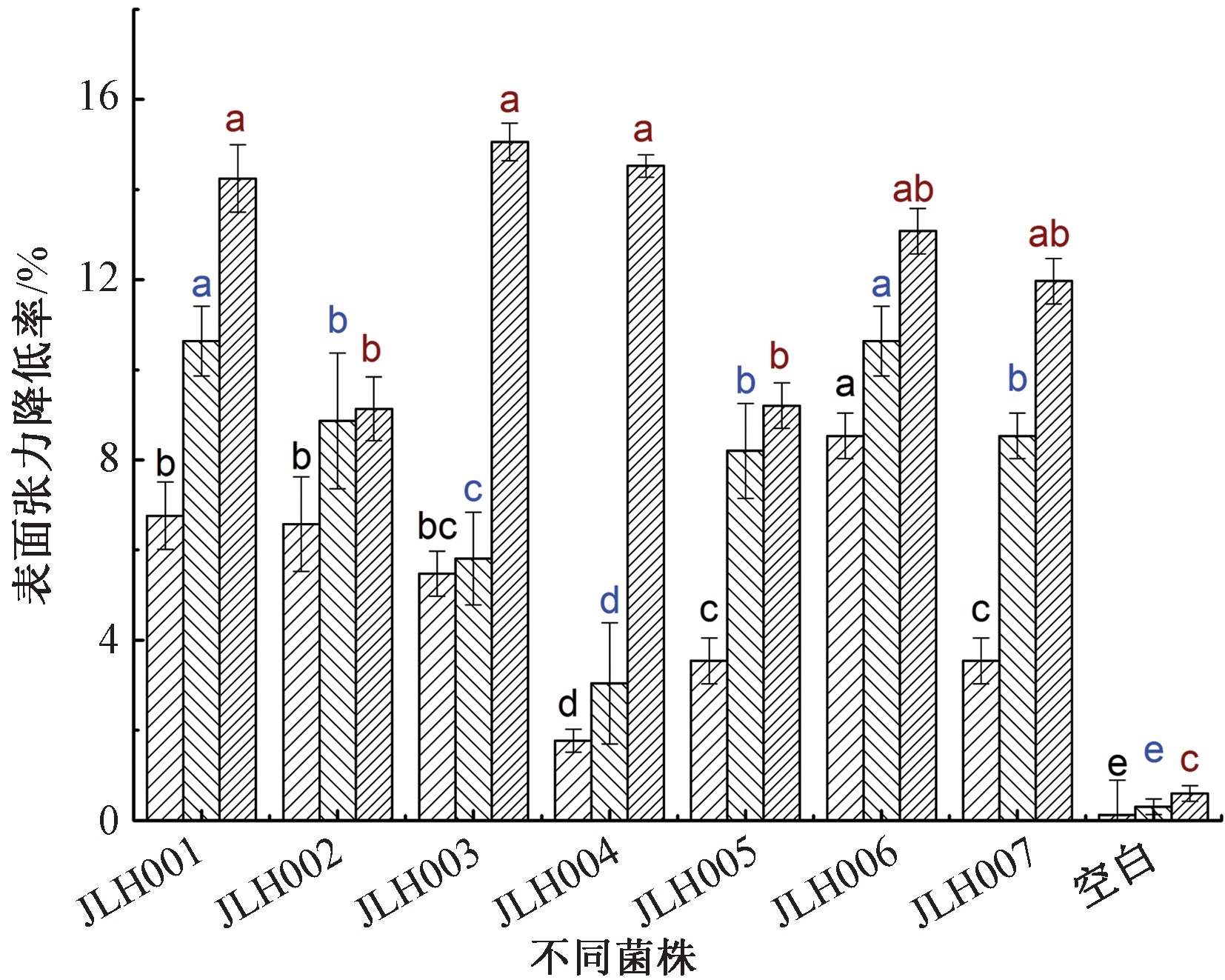
7株细菌在原油培养基中培养不同时间后,表面张力变化如图5所示。可知:培养5 d后,7株细菌的培养液表面张力均明显降低,其中JLH 006降低最明显;10 d后,培养液表面张力进一步降低;15 d后,表面张力降低情况更明显,其中JLH 001、JLH 003和JLH 004的表面张力降低显著。JLH 001和JLH 006的产表面活性剂能力最强,致表面张力降低最快,与文献[23, 24]报道结果一致,添加表面活性剂对其在石油中的生长并无明显促进作用。
![]() 5 d;
5 d; ![]() 10 d;
10 d; ![]() 15 d。
15 d。
注:误差线表示标准差,字母表示不同菌株间的差异,P<0.05。
图5 15 ℃下7株细菌在1%原油培养基中的表面张力变化
Figure 5 Surface tension change of seven isolated strains culture at 15 ℃ incubation in 1% crude oil media
2.4 低温菌群的石油降解
根据筛选的7株低温细菌对石油不同成分的降解能力,构建了6组低温石油降解菌群,并对菌群的石油降解情况进行了测定。这6组菌群分别为:
菌群CST 111:JLH 001,JLH 002,JLH 003,JLH 006;菌群CST 222:JLH 001,JLH 002,JLH 004,JLH 006;菌群CST 333:JLH 001,JLH 003,JLH 004,JLH 006;菌群CST 444:JLH 001,JLH 003,JLH 006,JLH 007;菌群CST 555:JLH 001,JLH 002,JLH 006,JLH 007;菌群CST 666:JLH 001,JLH 004,JLH 006,JLH 007。
利用尾气分析仪对菌群的石油降解过程中CO2浓度与O2浓度进行实时在线监测,表征菌群的石油降解能力。
2.4.1 不同菌群的石油降解特性
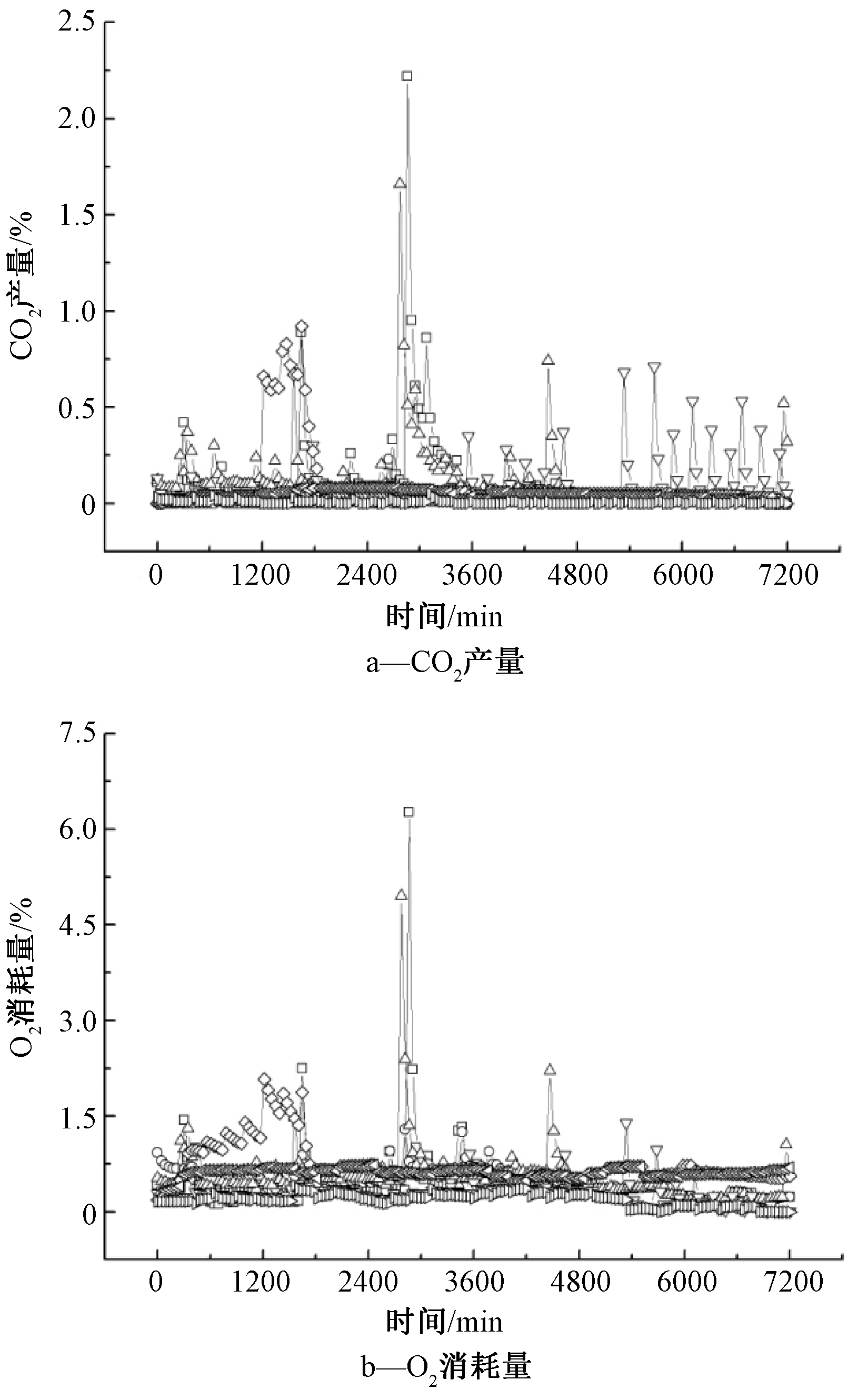
图6为15 ℃时不同菌群降解1%原油时CO2产生和O2消耗情况。可知:在15 ℃下,反应器石油降解过程中CO2增加曲线与O2消耗曲线变化一致,但不同菌群的CO2增加量与O2消耗量均表现出明显差异。其中,菌群CST 111表现出最高的石油降解能力,在48 h左右CO2产量和O2消耗量达到最高,分别为2.22%和6.27%,在72 h左右2种曲线渐趋于平缓,降解达到终点。菌群CST 333的CO2产量与O2消耗量在48 h左右达到最高。菌群CST 555最早进入降解完全阶段,在34 h左右达到降解终点,对石油的降解速度最快。
![]() —CST 111;
—CST 111; ![]() —CST 222;
—CST 222; ![]() —CST 333;
—CST 333; ![]() —CST 444;
—CST 444; ![]() —CST 555;
—CST 555; ![]() —CST 666;
—CST 666; ![]() —对照。
—对照。
图6 15 ℃下不同菌群降解1%原油时CO2的产生和O2的消耗变化
Figure 6 CO2 production and O2 consumption of crude oil degradation by different microfloras at 15 ℃
2.4.2 添加生物表面活性剂对菌群石油降解特性的影响
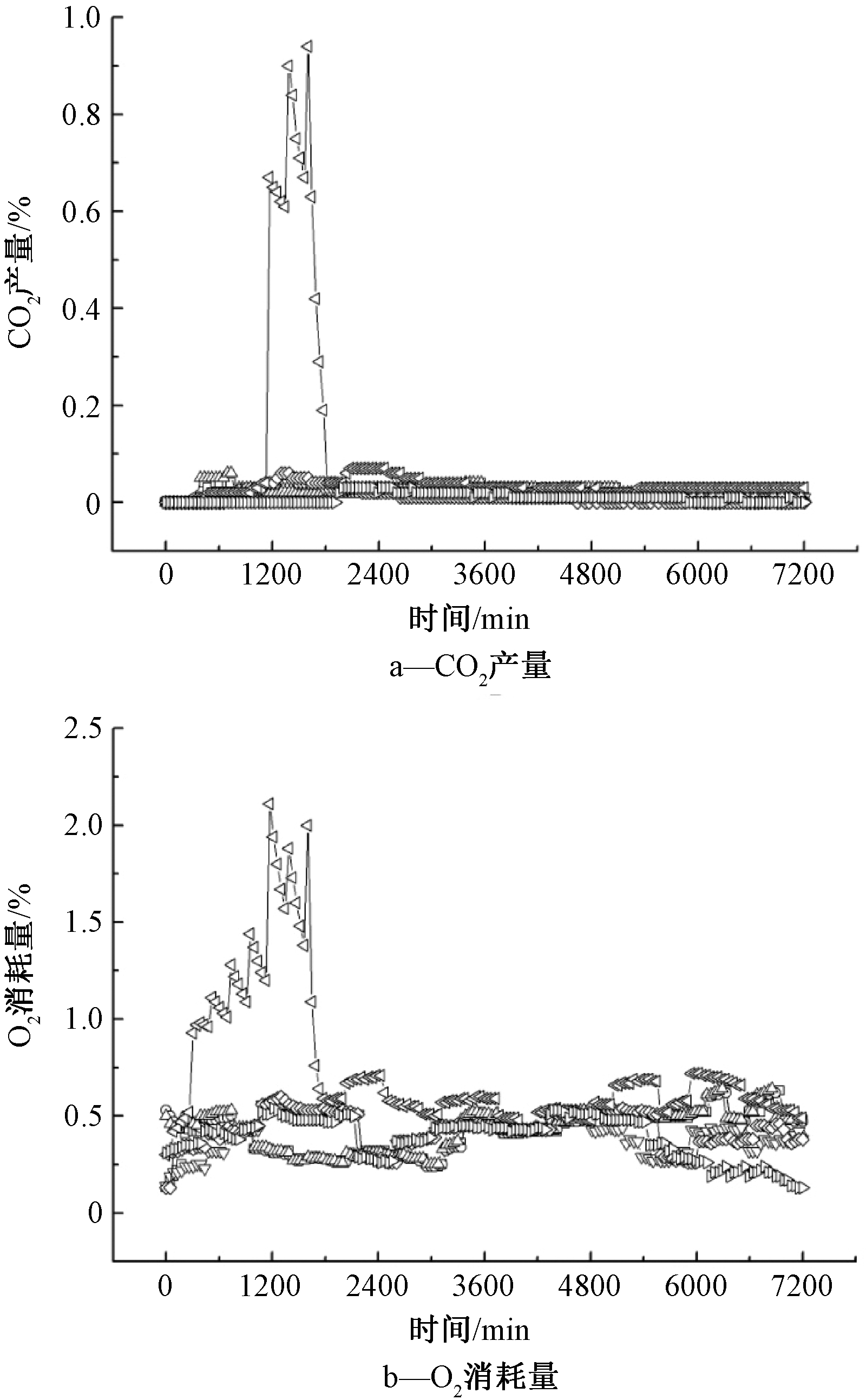
图7为添加鼠李糖脂对不同菌群降解1%原油CO2产生量和O2消耗量的影响。在15 ℃下添加鼠李糖脂后,菌群CST 666降解原油的CO2产量与O2消耗量最大,29 h达到峰值,分别为0.94%和2.11%;34 h菌群的CO2产量与O2消耗量趋于稳定,即进入了降解完成阶段,说明添加鼠李糖脂提高了菌群CST 666的石油降解率和降解速度,促进其降解。其他5个菌群,添加鼠李糖脂后降解石油的CO2产量与O2消耗量与图6未添加鼠李糖脂时相比,均大幅降低,鼠李糖脂对这些菌群的原油降解并未产生促进作用,即鼠李糖脂抑制了这些菌群中某些菌株在原油中的生长。
![]() —CST 111;
—CST 111; ![]() —CST 222;
—CST 222; ![]() —CST 333;
—CST 333; ![]() —CST 444;
—CST 444; ![]() —CST 555;
—CST 555; ![]() —CST 666;
—CST 666; ![]() —对照。
—对照。
图7 15 ℃下添加鼠李糖脂对不同菌群降解1%原油CO2产生和O2消耗影响
Figure 7 Effects of adding rhamnolipid on CO2 production and O2 consumption of crude oil degradation by different microfloras at 15 ℃
2.4.3 25 ℃下不同菌群的石油降解特性
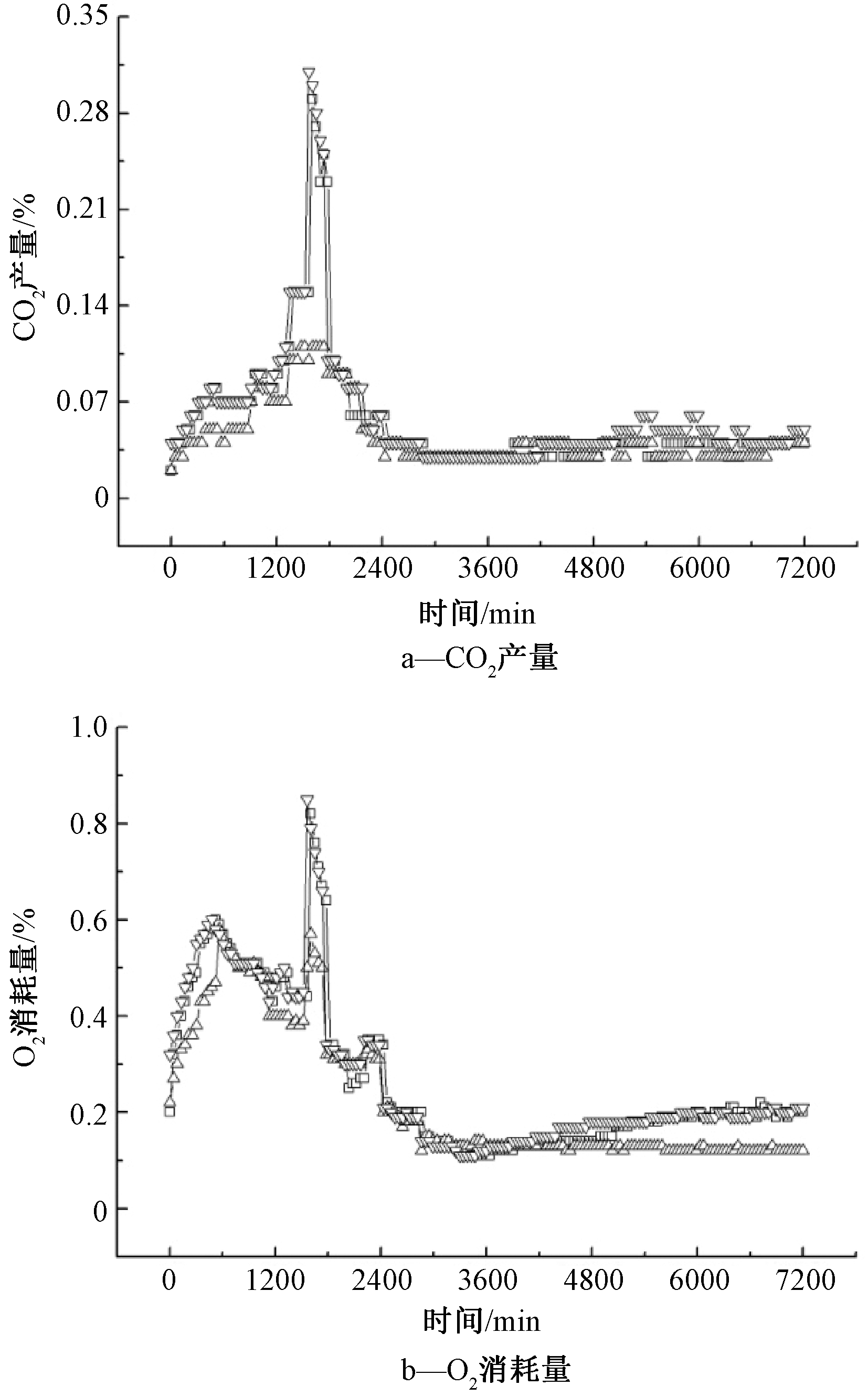
图8为25 ℃不同菌群降解1%原油时CO2产生和O2消耗情况。可知:在25 ℃下,菌群CST 111、CST 333和CST 444表现出较强的石油降解能力,比15 ℃下(图6)更早地达到CO2产量与O2消耗量的最高值,菌群CST 111和CST 333提前了约20 h进入降解完成阶段;温度对CST 444降解速度的促进效果则更为明显。一定程度的升温可以提高某些菌群的石油降解速度。
![]() —CST 111;
—CST 111; ![]() —CST 333;
—CST 333; ![]() —CST 444。
—CST 444。
图8 25 ℃下不同菌群降解1%原油时CO2产生和O2消耗变化
Figure 8 CO2 production and O2 consumption of crude oil degradation by different microfloras at 25 ℃
3 结 论
1)在15 ℃下以原油为唯一碳源,从石油污染土壤中筛选得到7株石油降解菌;形态学及16S rDNA菌株鉴定,最适生长温度分析证明其均为兼性嗜冷细菌。
2)基于7株低温细菌对正十六烷、环己烷和菲这3种石油烃的降解特性及产生物表面活性剂能力,构建了6组低温石油降解菌群,由Arthrobacter sp. JLH 001、Acinetobacter baumannii JLH 002、Pseudomonas fragi JLH 003、Arthrobacter sp. JLH 006组成的菌群CST 111的石油降解能力最强,在15 ℃时,生物反应器中1%的原油培养基在第2天达到石油降解最高点,第3天进入降解完成阶段;添加鼠李糖脂生物表面活性剂、提高温度可以在一定程度上提高菌群的石油降解速度。
[1] VARJANI S J. Microbial degradation of petroleum hydrocarbons [J]. Bioresource Technology, 2017, 223: 277-286.
[2] 李宝明. 石油污染土壤微生物修复的研究[D]. 北京: 中国农业科学院, 2007.
[3] 张学佳,纪巍,康志军,等. 石油类污染物对土壤生态环境的危害[J]. 化工科技, 2008, 16(6): 60-65.
[4] CHANDRA S, SHARMA R, SINGH K, et al. Application of bioremediation technology in the environment contaminated with petroleum hydrocarbon [J]. Annals of Microbiology, 2013, 63(2): 417-431.
[5] MECKENSTOCK R U, BOLL M, MOUTTAKI H, et al. Anaerobic degradation of benzene and polycyclic aromatic hydrocarbons [J]. Journal of Molecular Microbiology and Biotechnology, 2016, 26(1/2/3): 92-118.
[6] ZHANG Z Z, HOU Z W, YANG C Y, et al. Degradation of n-alkanes and polycyclic aromatic hydrocarbons in petroleum by a newly isolated Pseudomonas aeruginosa DQ8 [J]. Bioresource Technology, 2011, 102(5): 4111-4116.
[7] COSTA A S, ROMAO L P, ARAUJO B R, et al. Environmental strategies to remove volatile aromatic fractions (BTEX) from petroleum industry wastewater using biomass [J]. Bioresource Technology, 2012, 105: 31-39.
[8] SOUZA E C, VESSONI-PENNA T C, Oliveira R P S. Biosurfactant-enhanced hydrocarbon bioremediation: An overview [J]. International Biodeterioration & Biodegradation, 2014, 89: 88-94.
[9] 杜亚鲁, 胡韬, 彭琳. 土壤石油污染的生物修复技术研究进展[J]. 环境科学与技术, 2017, 40(增刊1): 133-138.
[10] ABBASIAN F, LOCKINGTON R, MALLAVARAPU M, et al. A comprehensive review of aliphatic hydrocarbon biodegradation by bacteria [J]. Applied Biochemistry Biotechnology, 2015, 176(3): 670-699.
[11] WILKES H, BUCKEL W, GOLDING B T, et al. Metabolism of hydrocarbons in n-alkane-utilizing anaerobic bacteria [J]. Journal of Molcular Microbiology and Biotechnology, 2016, 26(1/2/3): 138-151.
[12] GHAZALI F M, RAHMAN R N Z A, SALLEH A B, et al. Biodegradation of hydrocarbons in soil by microbial consortium [J]. International Biodeterioration & Biodegradation, 2004, 54(1): 61-67.
[13] JANBANDHU A, FULEKAR M H. Biodegradation of phenanthrene using adapted microbial consortium isolated from petrochemical contaminated environment [J]. Journal of Hazardous Materials, 2011, 187(1/2/3): 333-340.
[14] MITTAL A, SINGH P. Isolation of hydrocarbon degrading bacteria from soils contaminated with crude oil spills [J]. Indian Journal of Experimental Biology, 2009, 47(9): 760-765.
[15] HARAYAMA S, KASAI Y, HARA A. Microbial communities in oil-contaminated seawater [J]. Current Opinion in Biotechnology, 2004, 15(3): 205-214.
[16] 赵晓秀, 赵慧敏, 全燮, 等. 石油污染土壤中菲、蒽和正十六烷的微生物降解[J]. 生态学杂志, 2009,28(3):456-460.
[17] 钱奕忠. 微生物降解石油废水的研究[D]. 北京: 北京化工大学, 2001.
[18] 朱杰, 阮志勇,董卫卫,等. 一株高效烷烃降解菌Acinetobacter sp.LAM1007的分离鉴定及降解特性[J]. 微生物学通报, 2017,44(7):1535-1546.
[19] 温文静, 谭丽婵, 雒晓芳, 等. 嗜碱性假单胞菌对菲的降解研究[J]. 西北民族大学学报(自然科学版), 2016,37(3):58-61.
[20] 徐成斌, 王闻烨, 李鲜珠, 等. 一株菲降解菌的鉴定及降解特性[J]. 环境科学学报, 2015, 35(3):684-691.
[21] 杨乐. 产表面活性剂解烃菌的筛选及其降解条件研究[J]. 环境工程, 2015(6):153-157.
[22] LIU Y, ZENG G M, ZHONG H, et al. Effect of rhamnolipid solubilization on hexadecane bioavailability: enhancement or reduction? [J]. Journal of Hazardous Materials, 2017, 322(Pt B): 394-401.
[23] IN S, MNIF, DHOUHA G. Glycolipids biosurfactants; potential related biomedical and biotechnological applications[J]. Carbohydrate Research, 2015.
S, MNIF, DHOUHA G. Glycolipids biosurfactants; potential related biomedical and biotechnological applications[J]. Carbohydrate Research, 2015.
[24] 李敬龙, 刘晔, 潘爱珍. 生物表面活性剂及其应用[J]. 齐鲁工业大学学报, 2004, 18(2):41-46.