水体富营养化是水环境污染的主要问题,磷和氮营养素的浓度增加是营养化水体形成的主要原因。目前,常用生态修复方法、化学方法和物理方法处理营养化水体,虽然化学方法和物理方法见效快,但时效短,运行成本高,并对生态环境存在一定的潜在威胁。以植物为核心的水体营养化修复技术具有美化环境,治理效果好,运行成本低及易管理等优势,已成为生态环境治理领域的热点[1]。人工湿地被广泛应用于净化营养化水体,美人蕉(Cana generalis Bailey)与凤眼莲(Eichhornia Crassipes)是人工湿地生态修复富营养化水体的经典植物,具有吸收、富集和转移磷和氮能力强,耐污能力强的显著功能[2]。大花美人蕉为美人蕉科球茎类花卉植物,多年生直立草本,喜高温和阳光,开花期长,适应性强;凤眼莲俗名水葫芦,粉状胚乳目、雨久花科、凤眼蓝属浮水植物。研究表明:凤眼莲具有较好的生态修复技术脱氮除磷功能[3-5],大花美人蕉对污水中总氮(TN)、总磷(TP)的去除效果较好[6-7]。目前对大花美人蕉和凤眼莲的研究主要集中在繁育及对水体污染的修复效果等方面,但有关它们吸收![]() 的机理鲜有报道。本研究以大花美人蕉和凤眼莲为试验材料,研究这2种湿地植物吸收营养化水体中
的机理鲜有报道。本研究以大花美人蕉和凤眼莲为试验材料,研究这2种湿地植物吸收营养化水体中![]() 的效率与质膜H+-ATPase活性对之的影响,探讨PM H+-ATPase影响植物净化
的效率与质膜H+-ATPase活性对之的影响,探讨PM H+-ATPase影响植物净化![]() 效率的机制,为这2种湿地植物在水污染治理的应用提供科学依据。
效率的机制,为这2种湿地植物在水污染治理的应用提供科学依据。
1.1.1 模拟富营养化水体配制
模拟农田水体初始ρ(TN)设置为6.8 mg/L(其中![]() 为4.8 mg/L)外,其他营养元素按照霍格兰培养液成分设置。根据GB 3838—2002《地表水环境质量标准》中对Ⅴ类水水质的上限规定:ρ(TN)=2 mg/L[8],该农田水体为富营养化水体。
为4.8 mg/L)外,其他营养元素按照霍格兰培养液成分设置。根据GB 3838—2002《地表水环境质量标准》中对Ⅴ类水水质的上限规定:ρ(TN)=2 mg/L[8],该农田水体为富营养化水体。
1.1.2 植物的培养与处理
供试植物:大花美人蕉在湿地土壤中培养至株高20~30 cm时挖出,清洗干净,放在自来水中水培,每隔2 d换水1次,培养30 d左右至新根长成后进行实验。凤眼莲为浮水植物,从野外采集回来后放在自来水中,以相同方式进行培养。选取长势大小一致、鲜重相近的2种植物放入3 L模拟富营养化水体的容器内,用塑料薄膜盖在容器口,培养7 d,以上每种处理设置3个重复。处理期间,每天取200 μL水样分析![]() 浓度,用蒸馏水补充蒸发的微量水分,以保持容器中的水位。实验结束后将植物擦干称重,分别取处理24 h的植物根尖(0~20 mm)约0.5 g,液氮冷冻后保存于-80 ℃冰箱备用。
浓度,用蒸馏水补充蒸发的微量水分,以保持容器中的水位。实验结束后将植物擦干称重,分别取处理24 h的植物根尖(0~20 mm)约0.5 g,液氮冷冻后保存于-80 ℃冰箱备用。
植物鲜重增长率测定方法为:2种植物分别在处理前及在营养化水体中处理7 d后测定植株鲜重。植株增长率计算式为:植株增长率=(处理后植株鲜重-处理前植株鲜重)/处理前植株鲜重×100%。
![]() 浓度测定参照HJ/T 346—2007[9]《水质 硝酸盐的测定 紫外分光光度法》。叶片硝酸还原酶(NR)活性参照李合生等[10]的方法测定。参照Shen等[11]的方法提取植物根尖质膜蛋白,使用Bradford比色法测定质膜蛋白的浓度,然后参照Guo等[12]的方法检测质膜蛋白的纯度并测定PM H+-ATPase的活性。PM H+-ATPase与14-3-3蛋白的互作水平采用参照Zhou等[13]的方法,用免疫共沉淀 (CO-IP)技术分析。
浓度测定参照HJ/T 346—2007[9]《水质 硝酸盐的测定 紫外分光光度法》。叶片硝酸还原酶(NR)活性参照李合生等[10]的方法测定。参照Shen等[11]的方法提取植物根尖质膜蛋白,使用Bradford比色法测定质膜蛋白的浓度,然后参照Guo等[12]的方法检测质膜蛋白的纯度并测定PM H+-ATPase的活性。PM H+-ATPase与14-3-3蛋白的互作水平采用参照Zhou等[13]的方法,用免疫共沉淀 (CO-IP)技术分析。
所有的生理生化指标分析设置3次重复,用Excel计算平均值及误差,用Duncan’s法检验对所得数据进行显著性差异分析(P<0.05)。
植物对营养化水体的净化能力的最直观指标就是植物的生长情况,对2种植物在营养化水体中生长7 d的鲜重增长率的变化进行分析,结果如表1所示。可知:2种植物在营养化水体中处理后植物鲜重有不同程度的增加,大花美人蕉和凤眼莲鲜重较处理前分别增重15.4%、22.8%。这说明2种植物对营养化水体有较强的耐受能力,均能较好地生长,但大花美人蕉的鲜重增长率小于凤眼莲。
表1 农田废水处理不同时间的植物鲜重增长率、硝酸还原酶活性及质膜H+-ATPase活性变化
Table 1 Changes of fresh weight growth rate, NR activity and PM H+-ATPase activity of plants after treatingsimulative farmland wastewater for different time

植物种类处理7 d植物鲜重增长率/%处理24 h植物NR活性/(μg·g-1·h-1)处理24 h植物PMH+-ATPase活性/(μmol·mg-1·min-1)大花美人蕉0.15495.9829.34凤眼莲0.225121.9740.87
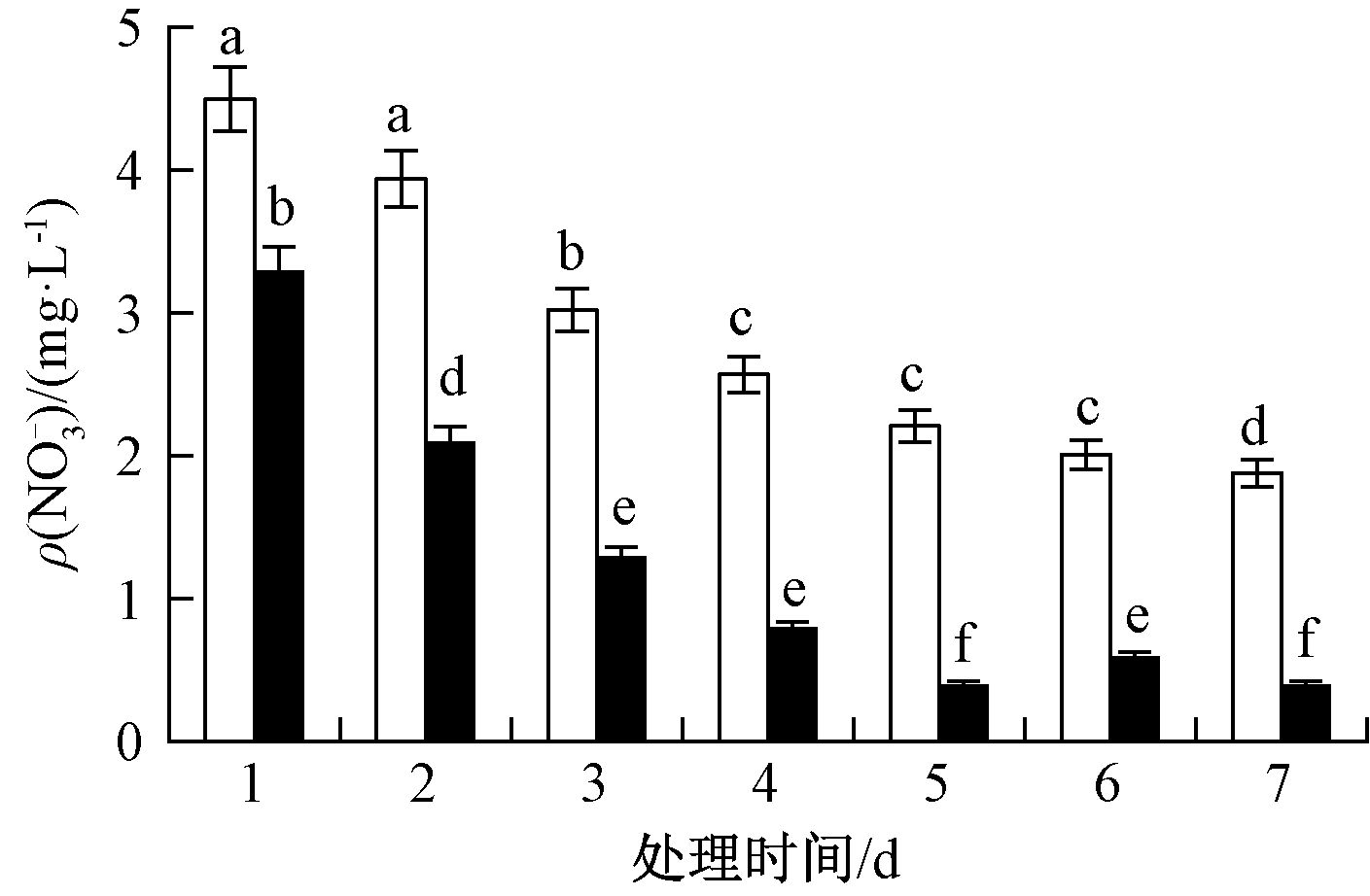
为了进一步评估2种植物对营养化水体中![]() 的净化效果,实验测定植物在营养化水体中处理1~7 d水体的
的净化效果,实验测定植物在营养化水体中处理1~7 d水体的![]() 浓度,结果如图1所示。可知:大花美人蕉处理的营养化水体中
浓度,结果如图1所示。可知:大花美人蕉处理的营养化水体中![]() 整体呈下降趋势。在1~4 d的营养化水体中
整体呈下降趋势。在1~4 d的营养化水体中![]() 显著降低,由初始浓度4.8 mg/L下降至
显著降低,由初始浓度4.8 mg/L下降至![]() 去除率达到61%。此后,营养水体中
去除率达到61%。此后,营养水体中![]() 浓度基本趋于稳定,第7天时水体
浓度基本趋于稳定,第7天时水体![]() 降低为
降低为![]() 浓度比处理前下降了65%。凤眼莲处理的营养化水体中
浓度比处理前下降了65%。凤眼莲处理的营养化水体中![]() 浓度下降较快,第5天时,水体
浓度下降较快,第5天时,水体![]() 仅为
仅为![]() 浓度比处理前下降了92%。由此可见,凤眼莲净化营养化水体
浓度比处理前下降了92%。由此可见,凤眼莲净化营养化水体![]() 的能力高于大花美人蕉。
的能力高于大花美人蕉。
 大花美人蕉;
大花美人蕉;  凤眼莲。
凤眼莲。
图1 2种植物处理营养化水体不同时间的![]() 含量变化
含量变化![]() content in eutrophic water treated by different plants for different time
content in eutrophic water treated by different plants for different time
硝酸还原酶(NR)是![]() 同化过程中的第1种酶,也是整个同化过程的限速酶,其活性直接影响
同化过程中的第1种酶,也是整个同化过程的限速酶,其活性直接影响![]() 的累积与同化过程。实验分析了2种植物的NR,结果如表1所示。可知:大花美人蕉、凤眼莲的NR活性分别为96,122 μg/(g·h),凤眼莲的NR活性高于大花美人蕉,表明凤眼莲对
的累积与同化过程。实验分析了2种植物的NR,结果如表1所示。可知:大花美人蕉、凤眼莲的NR活性分别为96,122 μg/(g·h),凤眼莲的NR活性高于大花美人蕉,表明凤眼莲对![]() 具有较高的转化、吸收能力。
具有较高的转化、吸收能力。
有研究表明,植物体内物质的跨膜运输与PM H+-ATPase的活性相关[14]。图1表明2种植物吸收![]() 的能力为凤眼莲>大花美人蕉,为进一步了解PM H+-ATPase活性是否与植物吸收
的能力为凤眼莲>大花美人蕉,为进一步了解PM H+-ATPase活性是否与植物吸收![]() 的效率有关,分析了营养水体处理24 h时2种植物根尖PM H+-ATPase的活性变化。由表1可知:大花美人蕉、凤眼莲的PM H+-ATPase活性分别为29.34,40.87 μmol/(mg·min),这2种植物根尖PM H+-ATPase活性大小与植物吸收
的效率有关,分析了营养水体处理24 h时2种植物根尖PM H+-ATPase的活性变化。由表1可知:大花美人蕉、凤眼莲的PM H+-ATPase活性分别为29.34,40.87 μmol/(mg·min),这2种植物根尖PM H+-ATPase活性大小与植物吸收![]() 的效率趋势一致。这与Elmore等[15]的研究结果相似,说明PM H+-ATPase活性影响植物对
的效率趋势一致。这与Elmore等[15]的研究结果相似,说明PM H+-ATPase活性影响植物对![]() 的吸收能力。
的吸收能力。
PM H+-ATPase与14-3-3蛋白的结合可以激活并稳定PM H+-ATPase的活性,实验提取了24 h的植物根尖质膜蛋白做免疫共沉淀(Co-IP)分析,如图2所示。可知:2种植物根尖PM H+-ATPase磷酸化水平及与之结合的14-3-3蛋白表达量变化趋势相同,并与PM H+-ATPase活性变化趋势一致,结合植物对![]() 的吸收能力与PM H+-ATPase活性的有关结果,表明PM H+-ATPase活性影响植物
的吸收能力与PM H+-ATPase活性的有关结果,表明PM H+-ATPase活性影响植物![]() 的吸收量。
的吸收量。
图2 营养水体处理24 h时不同植物根尖PM H+-ATPase
与14-3-3蛋白的互作水平(免疫共沉淀)的影响
Fig.2 The interaction of PM H+-ATPase and 14-3-3 proteins in roots of different plants treating eutrophic water for 24 h with Co-immunoprecipitation(Co-IP)analysis
大花美人蕉和凤眼莲为2种常见的湿地植物,广泛用于人工湿地修复水体与土壤。曹优明等[16]报导大花美人蕉对污水中氮的去除率可达80%,刘立岩等[17]发现凤眼莲2 d内可去除水中80%的含氮化合物,这些研究结果表明,大花美人蕉和凤眼莲对污水中的氮均具有较高的吸收率,植物生物量是判断植物净化营养化水体效果的重要指标。本研究以这2种植物为实验材料,对营养化水体![]() 的吸收能力及生物量增长率进行分析,发现大花美人蕉和凤眼莲对营养水体中
的吸收能力及生物量增长率进行分析,发现大花美人蕉和凤眼莲对营养水体中![]() 有显著的吸收作用,5 d内
有显著的吸收作用,5 d内![]() 净化率分别可达到63%、92%,这与文献[16-17]的研究结果相似。处理7 d后,2种植物鲜重生物量增长率为15.4%、22.8%,可能是由于这2种植物根系比较发达,有较快的增殖速度,需要大量的
净化率分别可达到63%、92%,这与文献[16-17]的研究结果相似。处理7 d后,2种植物鲜重生物量增长率为15.4%、22.8%,可能是由于这2种植物根系比较发达,有较快的增殖速度,需要大量的![]() 等营养物质,而凤眼莲的根系表面积大于大花美人蕉,所以凤眼莲净化营养水体
等营养物质,而凤眼莲的根系表面积大于大花美人蕉,所以凤眼莲净化营养水体![]() 的效果比大花美人蕉更显著。
的效果比大花美人蕉更显著。
质膜H+-ATPase(PM H+-ATPase)是广泛存在于植物质膜上丰度最大的一种功能蛋白,被誉为植物细胞的“主宰酶”,在植物细胞营养代谢过程中起关键作用[18-19]。14-3-3蛋白是在真核细胞中发现的一类高保守的调控蛋白,它可与磷酸化的PM H+-ATPase的C末端结合形成PM H+-ATPase/14-3-3蛋白的复合物,复合物代表PM H+-ATPase的一种活性状态[20]。PM H+-ATPase通过水解三磷酸腺苷(ATP)产生能量,将细胞质中的H+逆浓度泵出细胞外,在细胞膜两侧产生H+浓度梯度和膜电位,为氮、磷等营养物质的逆浓度跨膜运输与摄入提供驱动力和能量[21-22]。
植物根细胞对![]() 的吸收是植物氮代谢过程中的重要一步,是以
的吸收是植物氮代谢过程中的重要一步,是以![]() 同向转运的主动运输过程,需要消耗PM H+-ATPase 水解ATP产生的能量和H+,为
同向转运的主动运输过程,需要消耗PM H+-ATPase 水解ATP产生的能量和H+,为![]() 跨膜转运提供驱动力[23]。PM H+-ATPase与14-3-3蛋白的结合形成14-3-3蛋白和磷酸化PM H+-ATPase蛋白复合体,可以激活并稳定PM H+-ATPase的活性[24],最终表现为
跨膜转运提供驱动力[23]。PM H+-ATPase与14-3-3蛋白的结合形成14-3-3蛋白和磷酸化PM H+-ATPase蛋白复合体,可以激活并稳定PM H+-ATPase的活性[24],最终表现为![]() 的吸收量增加和植物生物量的增加。为了明确植物吸收
的吸收量增加和植物生物量的增加。为了明确植物吸收![]() 是否与PM H+-ATPase活性有关,实验分析了植物
是否与PM H+-ATPase活性有关,实验分析了植物![]() 吸收(图1)和NR活性(表1)的变化,并提取2种植物根尖质膜蛋白,分析了植物PM H+-ATPase活性(表1)及其与14-3-3蛋白的免疫共沉淀(Co-IP)分析(图2),发现凤眼莲根尖PM H+-ATPase 活性及蛋白表达量比大花美人蕉高,水解ATP的能力较强,释放出更多的能量和H+,产生跨膜pH梯度和跨膜电势梯度,为
吸收(图1)和NR活性(表1)的变化,并提取2种植物根尖质膜蛋白,分析了植物PM H+-ATPase活性(表1)及其与14-3-3蛋白的免疫共沉淀(Co-IP)分析(图2),发现凤眼莲根尖PM H+-ATPase 活性及蛋白表达量比大花美人蕉高,水解ATP的能力较强,释放出更多的能量和H+,产生跨膜pH梯度和跨膜电势梯度,为![]() 跨膜转运提供驱动力,因此,凤眼莲中
跨膜转运提供驱动力,因此,凤眼莲中![]() 的跨膜转运数量多于大花美人蕉。NR是
的跨膜转运数量多于大花美人蕉。NR是![]() 的吸收同化的诱导酶和限速酶,跨膜转运较多的
的吸收同化的诱导酶和限速酶,跨膜转运较多的![]() 在一定程度上诱导和激活了NR活性,
在一定程度上诱导和激活了NR活性,![]() 在细胞质中被NR降解成
在细胞质中被NR降解成![]() 逐步完成植物
逐步完成植物![]() 吸收同化过程,导致凤眼莲
吸收同化过程,导致凤眼莲![]() 的吸收能力大于大花美人蕉,其生物量增长率高于大花美人蕉,表明PM H+-ATPase参与植物
的吸收能力大于大花美人蕉,其生物量增长率高于大花美人蕉,表明PM H+-ATPase参与植物![]() 转运、吸收的调控,实验结果与周小华等[25]、陈东杰等[26]的研究结果相似,PM H+-ATPase活性与植物
转运、吸收的调控,实验结果与周小华等[25]、陈东杰等[26]的研究结果相似,PM H+-ATPase活性与植物![]() 吸收量呈正相关,PM H+-ATPase参与植物
吸收量呈正相关,PM H+-ATPase参与植物![]() 吸收的调控作用。
吸收的调控作用。
大花美人蕉与凤眼莲净化营养水体的![]() 效果均较好,去除率分别达到65%与92%,凤眼莲净化
效果均较好,去除率分别达到65%与92%,凤眼莲净化![]() 效果优于大花美人蕉,凤眼莲对水体
效果优于大花美人蕉,凤眼莲对水体![]() 的吸收量大,但凤眼莲是繁殖能力极强的外来物种,应注意结合生态安全综合考虑。
的吸收量大,但凤眼莲是繁殖能力极强的外来物种,应注意结合生态安全综合考虑。
凤眼莲根尖PM H+-ATPase活性及其与14-3-3蛋白互作水平强于大花美人蕉,为植物吸收同化![]() 提供大量H+和能量,从而提高了植物吸收
提供大量H+和能量,从而提高了植物吸收![]() 的能力和鲜重增长率,说明植物根系PM H+-ATPase活性直接影响植物对
的能力和鲜重增长率,说明植物根系PM H+-ATPase活性直接影响植物对![]() 的吸收,在调控植物
的吸收,在调控植物![]() 吸收的跨膜次级转运过程中发挥着重要作用。
吸收的跨膜次级转运过程中发挥着重要作用。
[1] Zhao Y, Yang Z F, Xia X H, et al. A shallow lake remediation regime with Phragmites australis: incorporating nutrient removal and water evapotranspiration[J]. Water Research, 2012, 46(17): 5635-5644.
[2] 郝明旭, 霍莉莉, 吴珊珊. 人工湿地植物水体净化效能研究进展[J]. 环境工程, 2017, 35(8): 5-10.
[3] Yan S H, Song W, Guo J Y. Advances in management and utilizationof invasive water hyacinth (Eichhorniacrassipes) in a aquatic ecosystems: a review [J]. Critical Reviews in Biotechnology, 2016, 37(2): 1-11.
[4] 闻学政,刘海琴,张迎颖,等. 凤眼莲和水浮莲对滇池草海水体中氮去除效果的比较研究[J].农业资源与环境学报, 2015,32 (4): 388-394.
[5] 张志勇, 徐寸发, 严少华, 等. 凤眼莲生态修复工程改善滇池水质及湖体氮磷收支平衡[J]. 农业工程学报, 2017,33(13):235-242.
[6] 张亚娟, 王军霞, 刘存歧, 等. 美人蕉浮床对富营养水体氮磷去除效果的研究进展[J]. 安徽农业科学, 2011, 39(10): 6053-6054.
[7] 吴诗杰, 陈慧娟, 许小桃, 等. 美人蕉、鸢尾、黄菖蒲和千屈菜对富营养化水体净化效果研究[J]. 安徽大学学报(自然科学版), 2016, 40 (1): 98-108.
[8] 国家环境保护总局,国家质量监督检验检疫总局.地表水环境质量标准:GB 3838—2002[S]. 北京: 中国科学出版社, 2002.
[9] 国家环境保护总局. 中华人民共和国环境保护行业标准:HJ/T 346—2007[S]. 北京:中国环境科学出版社,2007:1-2.
[10] 李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 119-120.
[11] Shen H, He L F, Sasaki T, et al. Citrate secretion coupled with the modulation of soybean root tip under aluminum stress. Up-regulation of transcription, translation, and threonine-oriented phosphorylation of plasma membrane H+-ATPase[J]. Plant Physiology, 2005, 138(1): 287-296.
[12] Guo C L, Chen Q, Zhao X L, et al. Al-enhanced expression and interaction of 14-3-3 protein and plasma membrane H+-ATPase is related to Al-induced citrate secretion in an Al-resistant black soybean[J]. Plant Molecular Biology Reporter, 2013, 31(4): 1012-1024.
[13] Zhou X H, Gu Z H, Xu H N et al. The effects of exogenous ascorbic acid on the mechanism of physiological and biochemical responses to nitrate uptake in two rice cultivars (Oryza sativa L.) under aluminum stress[J]. Journal of Plant Growth Regulation, 2016, 35(4): 1013-1024.
[14] Zhang R P, Liu G, Wu N, et al. Adaptation of plasma membrane H+-ATPase and H+-pump to P de ciency in rice roots[J]. Plant and Soil, 2011, 349(1/2): 3-11.
ciency in rice roots[J]. Plant and Soil, 2011, 349(1/2): 3-11.
[15] Elmore J M, Coaker G. The role of the plasma membrane H+-ATPase in plant-microbe interactions[J].Molecular Plant, 2011, 4(3): 416-427.
[16] 曹优明. 美人蕉人工湿地对城市生活污水的净化研究[J]. 环境科学技术, 2009, 32(7): 120-124.
[17] 刘立岩, 吕兴娜. 用凤眼莲净化水质中氮、磷污染物的研究分析[J]. 丹东纺专学报, 2005, 12(2): 40-41.
[18] Morsomme P, Boutry M. The plant plasma membrane H+-ATPase: strcture, function and regulation[J]. Biochim Biophysica Acta, 2000, 1465(1/2): 1-16.
[19] Rengel Z, Bose J, Chen Q, et al. Magnesium alleviates plant toxicity of aluminium and heavy metals[J]. Crop and Pasture Science, 2015, 66(12): 1298-1307.
[20] Kerkeb L, Venema K, Donaire J P, et al. Enhanced H+-ATP coupling ratio of H+-ATPase and increased 14-3-3 protein content in plasma membrane of tomato cells upon osmotic shock[J]. Physiologia Plantarum, 2002, 116(1): 37-41.
[21] Sondergaard T E, Schuijz A, Palmgren M G. Energization of transport processes in plants.roles of the plasma membrane H+-ATPase[J]. Plant Physiology, 2004, 136(1): 2475-2482.
[22] Falhof J, Pedersen J T, Fuglsang A T, et al. Plasma membrane H+-ATPase regulation in the center of plant physiology[J]. Molecular Plant, 2016, 9(3): 323-337.
[23] McClure P R, Kochian L V, Spanswick R M, et al. Evidence for cotransport of nitrate and protons in maize roots Ⅱ. Measurement of ![]() and H+ fluxes with ion-selective microelectrodes[J]. Plant Physiology, 1990, 93(1): 290-294.
and H+ fluxes with ion-selective microelectrodes[J]. Plant Physiology, 1990, 93(1): 290-294.
[24] Alterfjord M, Sehnke P C, Arkell A. Plasma membrane H+-ATPase and 14-3-3 isoforms of Arabidopsis leaves: evidence for isoform speci city in the 14-3-3/H+-ATPase interaction[J]. Plant Cell Physiol, 2004, 45(9): 1202-1210.
city in the 14-3-3/H+-ATPase interaction[J]. Plant Cell Physiol, 2004, 45(9): 1202-1210.
[25] 周小华, 徐慧妮, 谷照虎, 等. 铝胁迫下质膜H+-ATPase对水稻硝态氮吸收的影响[J]. 植物生理学报, 2016, 52 (7): 1011-1018.
[26] 陈东杰, 王平, 庞晓璐, 等. 铝胁迫下不同耐铝性黑大豆硝态氮吸收机理研究[J]. 大豆科学, 2014, 33(6): 870-875.