0 引 言
镉在电镀、金属加工、纺织、蓄电池、采矿、陶瓷和玻璃等行业均有释放,导致其在自然水体和土壤中积累[1-3]。在环境体系中,镉等重金属离子难以被降解,易在生物体内大量富集,威胁人类健康和生态安全[4]。GB 3838—2002《地表水环境质量标准》和GB 5749—2006《生活饮用水卫生标准》中镉的限定浓度分别为10,5 μg/L。
去除水中重金属的主要方法有化学沉淀法、离子交换法、吸附法、膜分离法和电解法等[5-6]。这些方法或成本比较高,或会产生大量的固体废物和有毒气体(如硫化物沉淀法)等[7]。吸附法因其高效率、低成本、易操作而成为一种常用方法。目前,常用吸附剂有活性炭[8]、生物炭[9]、蒙脱石[10]、铁矿石[11]等。针铁矿(α-FeOOH) 是土壤中广泛分布的无机胶体,由于具有稳定的化学性质、较高的比表面积及丰富的功能基团——羟基,可以作为一种良好的吸附剂[12]。而国内外对针铁矿吸附Cd(Ⅱ)的研究鲜有报道。
本实验主要研究针铁矿对镉的吸附效能以及 pH值和离子强度对针铁矿Cd(Ⅱ)的影响,以期为针铁矿用于含镉废水的处理提供参考。
1 实验部分
1.1 针铁矿的制备与表征
针铁矿的制备:实验所用针铁矿为人工合成针铁矿,按照文献[13]方法合成。配制50 mL 1 mol/L Fe(NO3)3和90 mL 5 mol/L KOH 溶液,将KOH 溶液加入Fe(NO3)3溶液中,加入1 L 蒸馏水稀释,加热到70 ℃保持60 h,之间大量红棕色水铁矿悬浮液变成黄色沉淀,用去离子水反复洗涤至 pH值为 7.0,离心,在-48 ℃下真空干燥针铁矿样品24 h 后,用研钵捣碎,过100目筛放入干燥器中待用。
针铁矿的表征:通过X射线粉末衍射仪测定晶体结构。表面物理性质采用ASAP-2020比表面积分析仪(micromeritics instrument corporation, US)在 77 K条件下对N2吸附特征进行测定。针铁矿的表面积(SA)采用Brunauer-Emmett-Teller(BET)方程式计算。
1.2 吸附实验设计
针铁矿吸附动力学实验:取150 mL 质量浓度为 50 mg/L用Cd(NO3)2配制的Cd(Ⅱ)溶液,用0.1 mol/L HNO3/NaOH调节溶液pH为5,加入0.15 g针铁矿,控制在25 ℃吸附,于5 min~48 h内取样,过0.22 μm水系滤膜,采用火焰原子吸收分光光度计测定滤液中Cd(Ⅱ)的质量浓度。
针铁矿等温吸附实验:取50 mL质量浓度为10~100 mg/L的Cd(Ⅱ)溶液,用0.1 mol/L HNO3/NaOH调节溶液pH为5,分别加入0.05 g针铁矿,置于25 ℃的空气浴中振荡24 h后过滤,测定滤液中Cd(Ⅱ)的质量浓度。
pH值对针铁矿吸附Cd(Ⅱ)的影响:取50 mL质量浓度为50 mg/L的Cd(Ⅱ)溶液,用0.1 mol/L HNO3/NaOH调节溶液pH值分别为1、2、3、4、5、6、7,加入0.05 g针铁矿,控制25 ℃下吸附24 h后过滤,测定滤液中Cd(Ⅱ)的质量浓度。
离子强度对针铁矿吸附Cd(Ⅱ)的影响:配制50 mL质量浓度为50 mg/L的Cd(Ⅱ)溶液,分别选取CaCl2、MgCl2作为电解质,使其浓度为0~0.025 mol/L,调节Cd(Ⅱ)溶液pH值为5,称取0.05 g针铁矿,置于25 ℃的空气浴中振荡24 h后过滤,测定滤液中Cd(Ⅱ)的质量浓度。
1.3 数据分析
用Origin 8.0软件对吸附数据进行Langmuir和Freundlich、二级动力学模型拟合,公式如下:
Langmuir模型:
Ce/Qe=1/(bQm)+Ce/Qm
(1)
Freundlich模型:
lnQe=lnKf+(lnCe)/n
(2)
式中:Ce为吸附平衡时Cd(Ⅱ)的浓度,mg/L;Qm为单分子层最大吸附量,mg/g;Qe为吸附量,mg/g;b为吸附特征常数,L/mg;n为非线性指数;Kf为吸附能力参数,(mg/g)/(mg/L)n。
二级动力学模型:
式中:Qm为平衡吸附量拟合值,mg/g;Qt为t时刻吸附量,mg/g;K为吸附速率常数;t为吸附时间,min。
2 结果与讨论
2.1 针铁矿的表征
图1为针铁矿X射线粉末衍射图谱和标准图谱,与标准图谱卡对比,其特征峰完全符合针铁矿的特征峰。图2是针铁矿在77 K条件下对N2的吸附-脱附等温线。根据IUPAC的分类标准,针铁矿的吸附-脱附等温线属于Ⅱ型曲线。针铁矿的的吸附和脱附等温线相互重合且无滞后回环,表明未发生孔填充作用。用BET方程式计算的针铁矿比表面积(SA)为82.364 m2/g,总孔容积为0.1748 mL/g,孔径为8.491 nm。
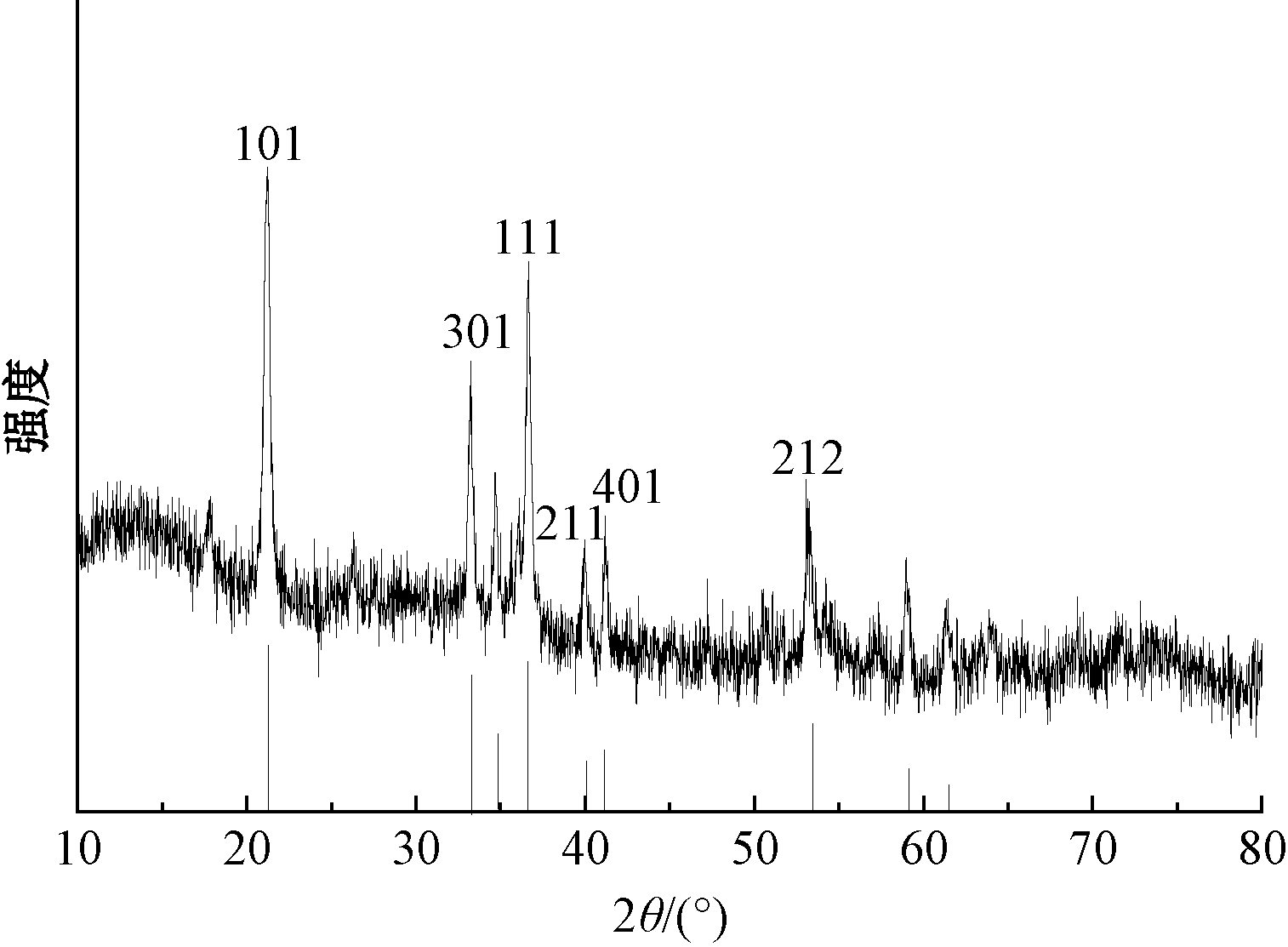
图1 针铁矿XRD分析图谱
Fig.1 XRD analysis results of goethite

![]() —吸附等温线;
—吸附等温线; ![]() —脱附等温线。
—脱附等温线。
图2 N2-BET吸附-脱附等温线
Fig.2 N2-BET adsorption-desorption isotherm
2.2 针铁矿吸附动力学分析
考察时间对针铁矿吸附Cd(Ⅱ)吸附效能的影响,结果如图3所示。针铁矿吸附Cd(Ⅱ)过程大致分为2个阶段,0~120 min吸附速率很快,120 min以后吸附速率减缓,约在480 min后吸附达到平衡,此时平衡吸附量为35.66 mg/g。
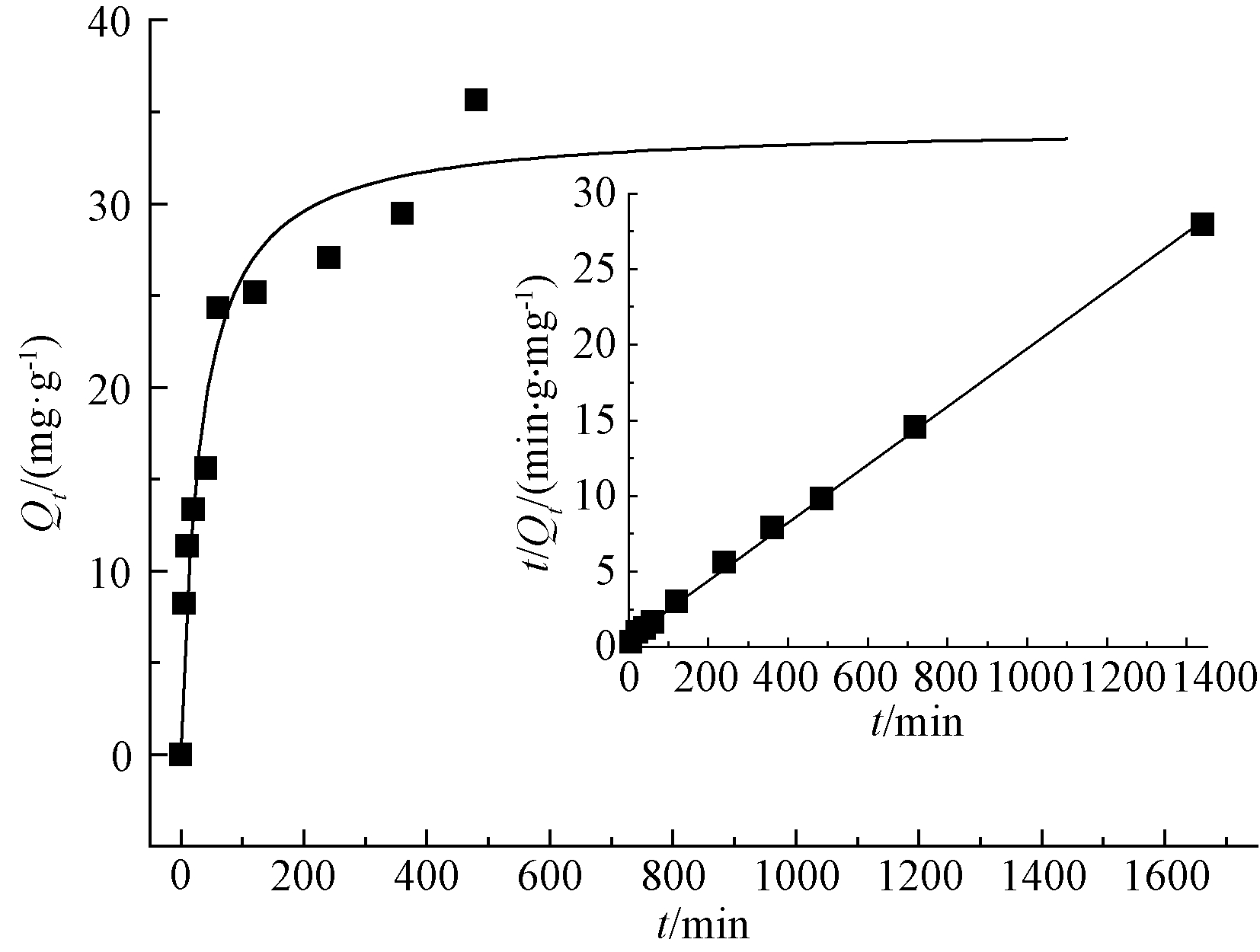
图3 针铁矿吸附Cd(Ⅱ)动力学模型
Fig.3 Kinetic model for adsorption of Cd(Ⅱ) on goethite
针铁矿吸附动力学符合二级动力学模型,其相关系数R2达到0.9535,吸附平衡时间约8 h,Cd(Ⅱ)浓度为50 mg/L,吸附剂浓度为1 g/L,pH在5时,最大吸附量为35.66 mg/g。
2.3 针铁矿吸附Cd(Ⅱ)等温吸附分析
由表1和图4—5可以看出:对比Langmuir和Freundlich 2种等温吸附方程的拟合结果,Langmuir方程能更好地描述针铁矿吸附Cd(Ⅱ)的特性,其相关系数R2达到0.9915。Langmuir 模型是单分子层吸附模型,而化学吸附生成单分子层,说明针铁矿吸附剂吸附Cd(Ⅱ)的过程以化学吸附为主[14]。
Ramos等[15]采用活性炭吸附溶液中镉离子,最大吸附量约为8 mg/g;DANIEL 等[16]用磷酸对两种水果核制备的活性炭进行改性,改性后的两种果核活性炭对镉离子的最大吸附量分别为26.33,24.83 mg/g;Asuquo等[17]采用市售的多孔活性炭吸附去除水中镉离子,吸附能力达到27.73 mg/g。本实验中针铁矿吸附镉的能力达到35.29 mg/g,强于一般活性炭对镉的吸附能力。
表1 针铁矿吸附Cd(Ⅱ)的Langmuir和Freundlich方程相关参数
Table 1 Langmuir equation and Freundlich equation related parameters of goethite adsorbing Cd(Ⅱ)
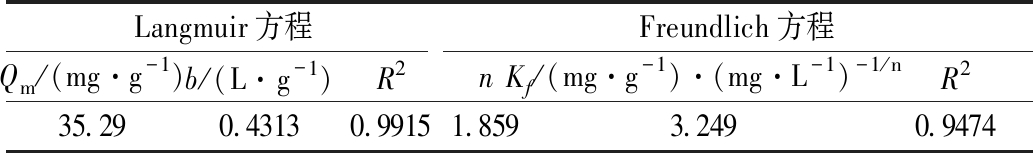
Langmuir方程Freundlich方程Qm/(mg·g-1)b/(L· g-1)R2nKf/(mg·g-1)·(mg·L-1)-1/nR235.290.43130.99151.8593.2490.9474
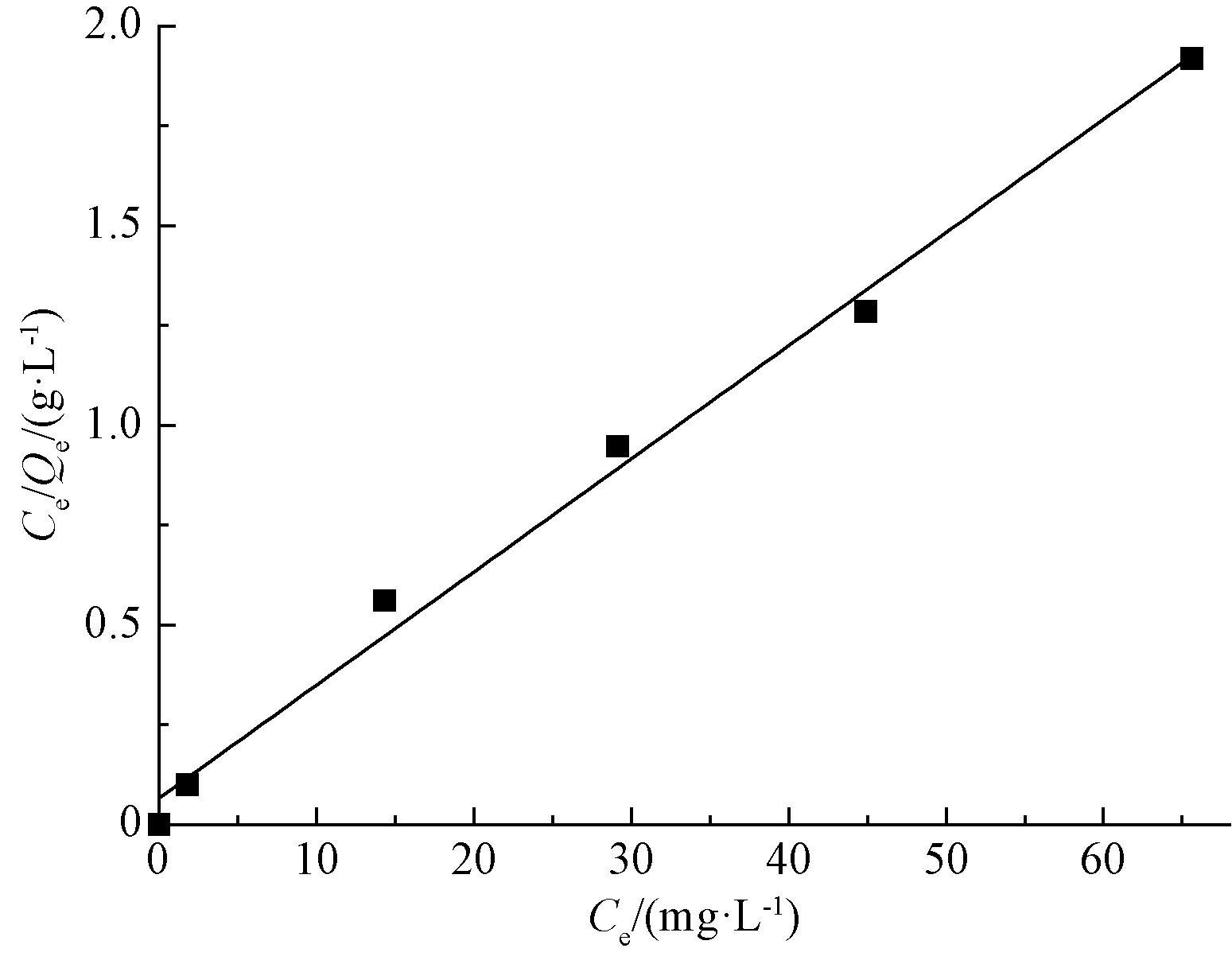
图4 针铁矿吸附Cd(Ⅱ) Langmuir模型
Fig.4 Langmuir model for adsorption of Cd(Ⅱ) on goethite
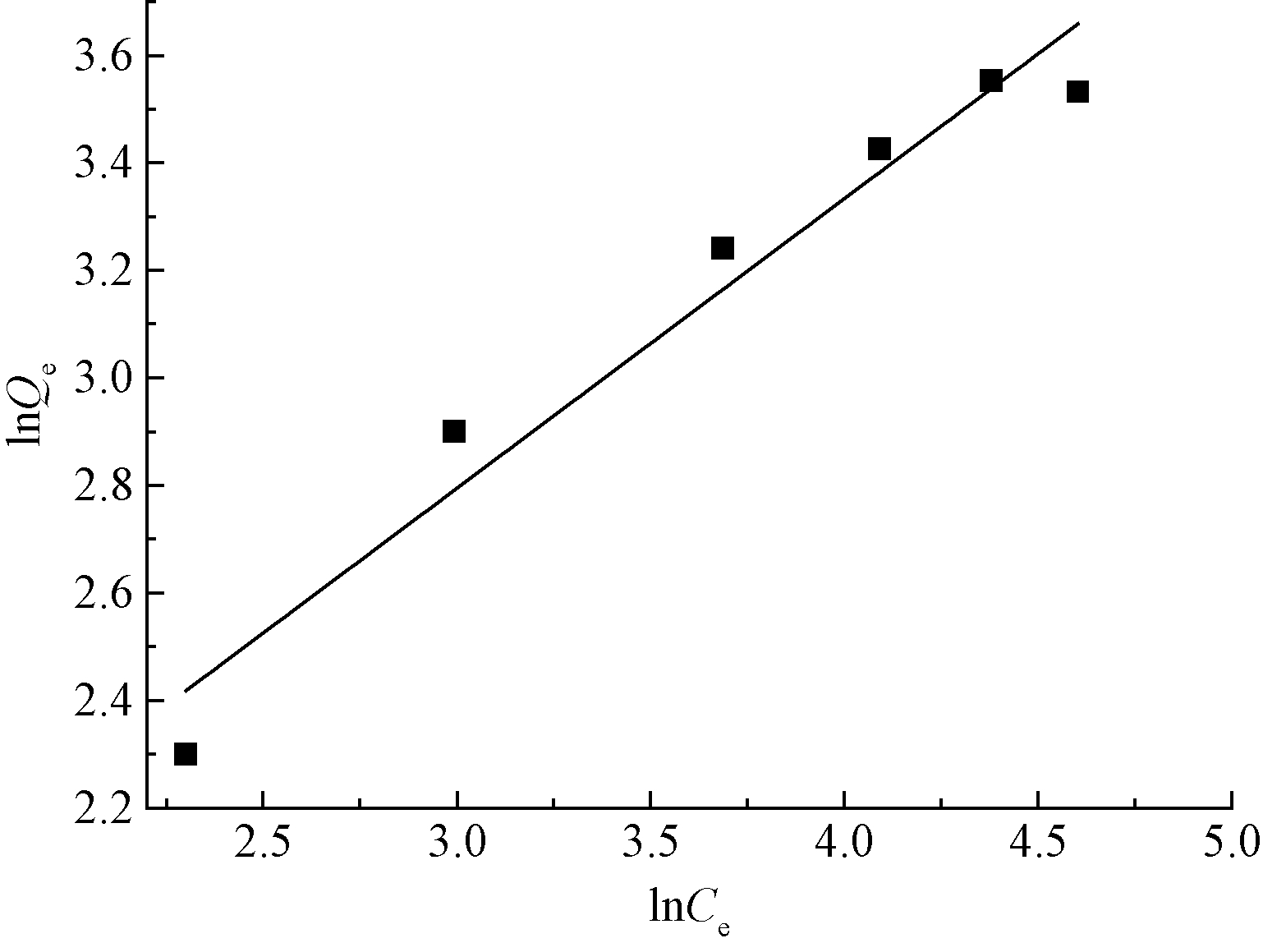
图5 针铁矿吸附Cd(Ⅱ) Freundlich模型
Fig.5 Freundlich model for adsorption of Cd(Ⅱ) on goethite
2.4 pH值对活性炭吸附 Cd(Ⅱ)的影响以及针铁矿的溶解率
pH值对 Cd(Ⅱ)吸附性能的影响以及不同pH下针铁矿的溶解率见表2。可知:当pH为1~2时针铁矿溶解率为10.25%~16.71%,当pH>3时针铁矿几乎不溶解。
表2 pH值对 Cd(Ⅱ)吸附性能的影响以及不同pH下针铁矿的溶解率
Table 2 Influence of pH value on adsorption properties of Cd(Ⅱ) and the dissolution rates of goethite under different pH
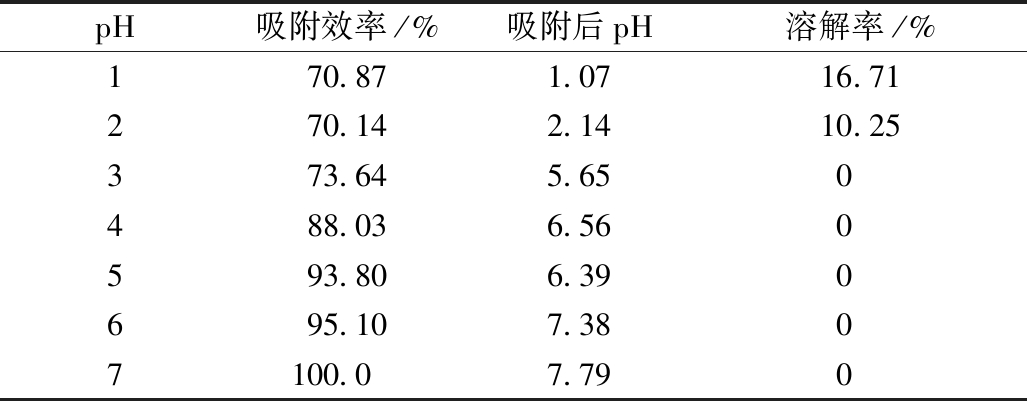
pH吸附效率/%吸附后pH溶解率/%170.871.0716.71270.142.1410.25373.645.650488.036.560593.806.390695.107.3807100.07.790
pH分别为3~7时,溶液中针铁矿对Cd(Ⅱ)的吸附量随着pH增大而增大,在pH为7时吸附效率达到100%。当pH>6时,吸附后pH>7,此时镉离子会形成沉淀,影响吸附结果。故将吸附环境pH控制在4~5时,吸附后pH为6.39~6.56时,可减少Cd(Ⅱ)形成沉淀。
当溶液pH较低时,溶液中H+浓度很高,在针铁矿表面存在大量H+与Cd2+形成很强的竞争作用,无足够的吸附点位供Cd2+发生吸附反应,故针铁矿的吸附量降低[18]。另外,溶液pH 影响吸附剂表面的电荷性,亦影响Cd2+的吸附。朱志良等[19]测定出α-FeO(OH)的零点电荷值为6.4。当溶液pH 值低于其零点电荷时,吸附剂表面带正电荷,与溶液中的Cd2+相互排斥[20-21],低pH 值抑制了针铁矿对Cd2+的吸附作用。随着溶液pH 的升高,溶液中OH-浓度增大,OH-与针铁矿表面H+结合,减少了H+与Cd2+间的静电排斥作用,溶液中H+浓度降低,H+的竞争作用逐渐减弱[22],使得Cd2+易与针铁矿表面带负电位的结合位点结合,针铁矿对Cd2+的吸附量增大。
2.5 离子强度对针铁矿吸附Cd(Ⅱ)的影响
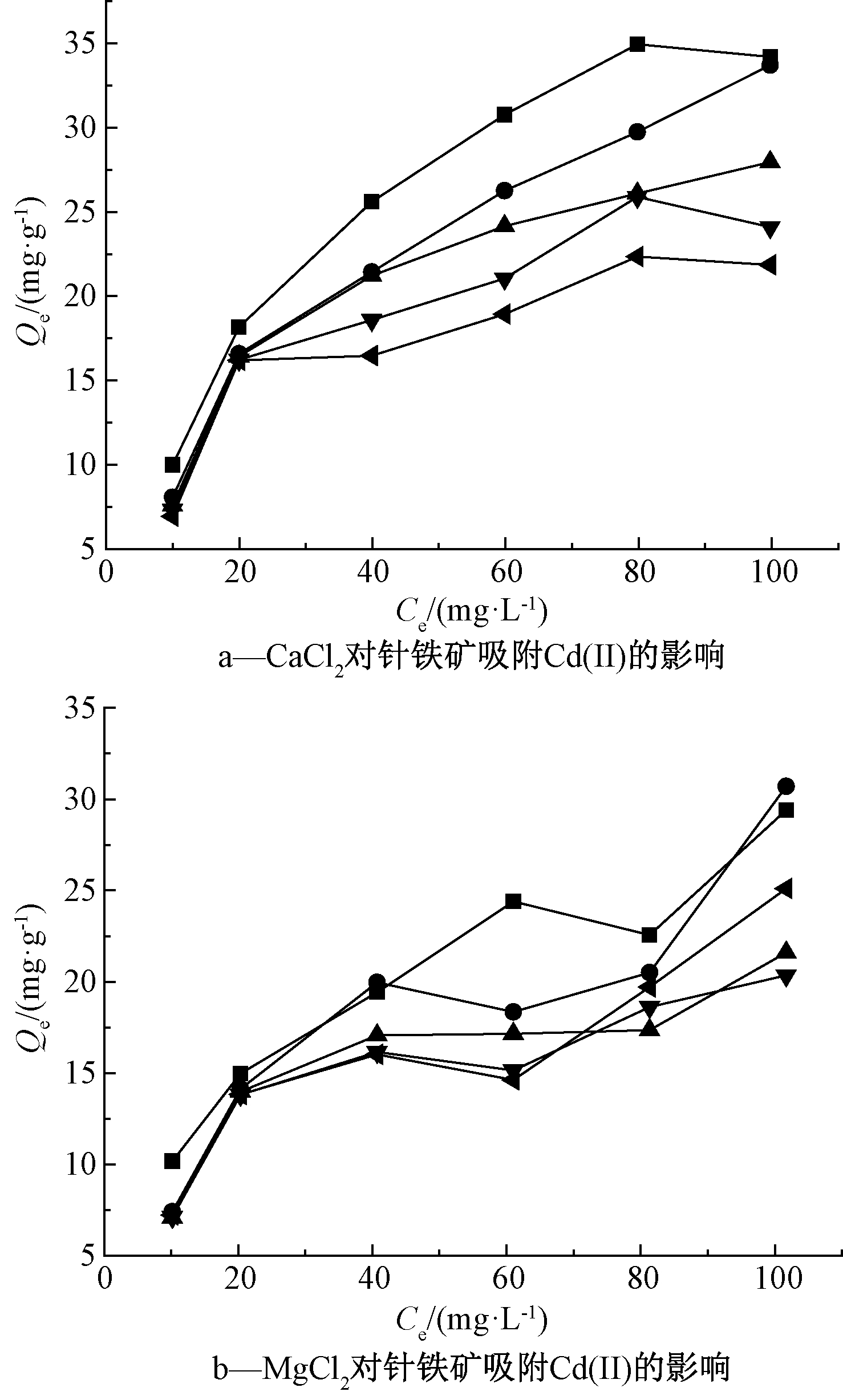
离子强度对针铁矿吸附Cd(Ⅱ)的影响见图6。可知:当CaCl2和MgCl2离子强度从0增至0.025 mol/L时,针铁矿吸附效果降低,CaCl2和MgCl2离子强度对针铁矿吸附Cd(Ⅱ)有抑制作用。
![]() —0 mol/L;
—0 mol/L; ![]() —0.005 mol/L;
—0.005 mol/L; ![]() —0.010 mol/L;
—0.010 mol/L; ![]() —0.015 mol/L;
—0.015 mol/L; ![]() —0.025 mol/L。
—0.025 mol/L。
图6 离子强度对针铁矿吸附Cd(Ⅱ)的影响
Fig.6 Effect of ionic strength on adsorption of Cd(Ⅱ) on goethite
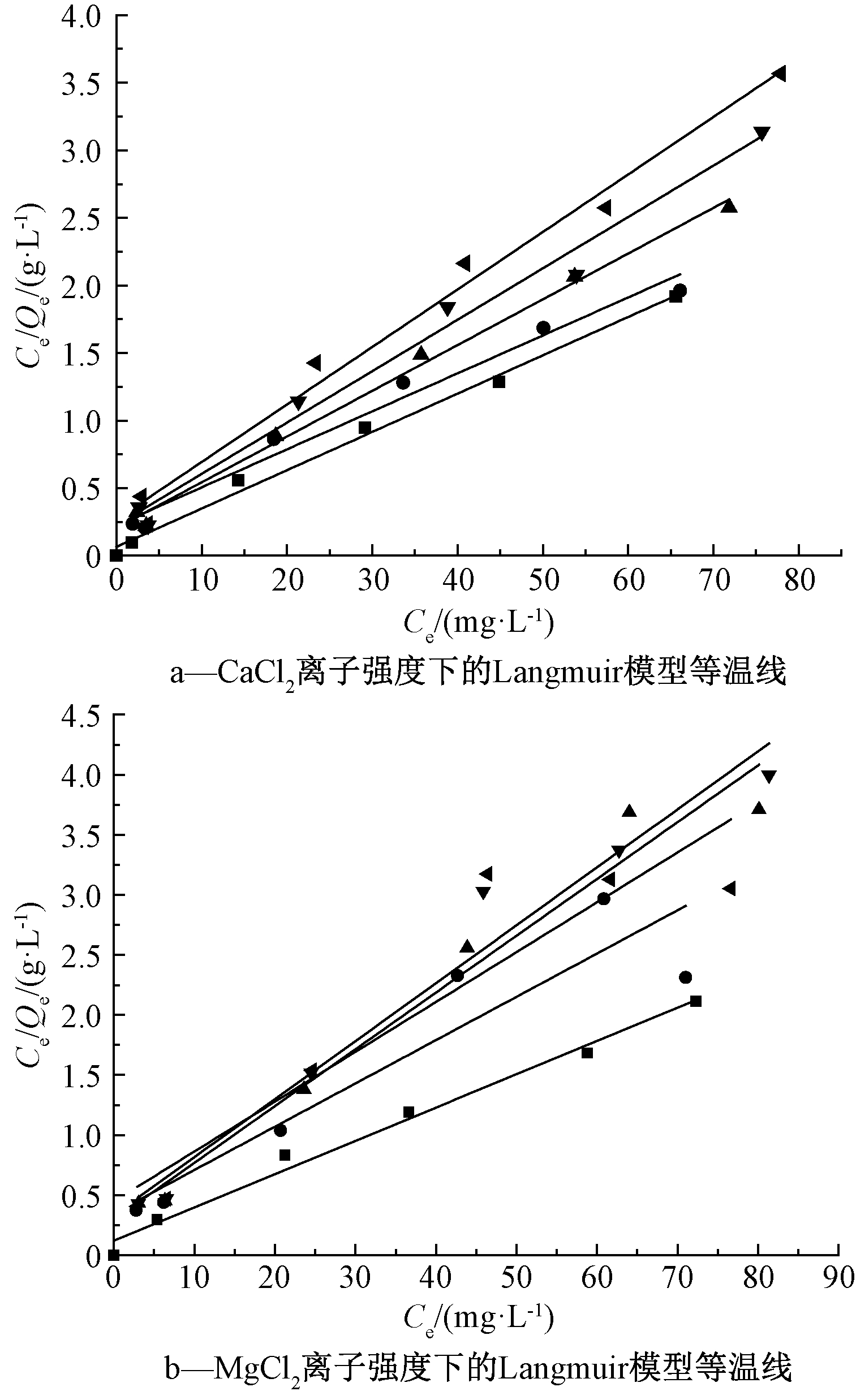
不同离子强度下针铁矿对Cd(Ⅱ)的吸附等温线和拟合参数见表3和图7。可知:在不同离子强度下,针铁矿对Cd(Ⅱ)的吸附等温线均表现出良好的线性,吸附拟合参数见表3。由图7和表3的Langmuir吸附拟合参数K可以看出:随着CaCl2的浓度升高,针铁矿对Cd(Ⅱ)的吸附能力逐渐降低,最大吸附量由34.60 mg/g降至23.53 mg/g,不同离子浓度间的样品吸附量经方差分析差异呈显著水平(P<0.05),可见Ca2+离子对针铁矿的吸附能力有显著影响。Mg2+离子对针铁矿吸附影响具有同样的趋势。
![]() 0 mol/L;
0 mol/L;![]() 0.005 mol/L;
0.005 mol/L;![]() 0.01 mol/L;
0.01 mol/L; ![]() 0.015 mol/L;
0.015 mol/L;![]() 0.025 mol/L。
0.025 mol/L。
图7 不同CaCl2和MgCl2离子强度下针铁矿吸附
Cd(Ⅱ)的Langmuir模型等温线
Fig.7 Langmuir model isotherms of Cd(Ⅱ) adsorbed by goethite under different ionic strength
表3 不同离子影响强度下Langmuir拟合参数
Table 3 Langmuir fitting parameters under the influence of different ionic strength
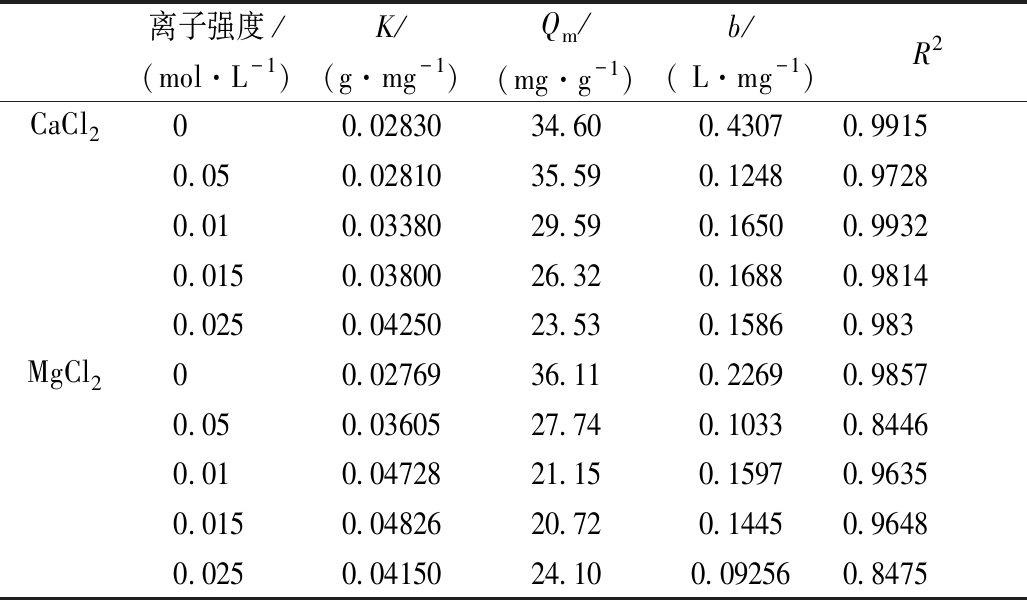
离子强度/(mol·L-1)K/(g·mg-1)Qm/(mg·g-1)b/( L·mg-1)R2CaCl200.0283034.600.43070.99150.050.0281035.590.12480.97280.010.0338029.590.16500.99320.0150.0380026.320.16880.98140.0250.0425023.530.15860.983MgCl200.0276936.110.22690.98570.050.0360527.740.10330.84460.010.0472821.150.15970.96350.0150.0482620.720.14450.96480.0250.0415024.100.092560.8475
一般认为,电解质的加入压缩了双电层的厚度,削弱了吸附质与吸附剂之间的静电作用[23], MgCl2和CaCl2的加入增加了溶液中的电解质,降低了针铁矿对Cd(Ⅱ)的吸附。然而Ca2+与Mg2+又能与Cd(Ⅱ)形成竞争性吸附,降低了针铁矿吸附Cd(Ⅱ)的能力。
3 结 论
1)针铁矿吸附Cd(Ⅱ)符合Langmuir模型和二级动力学模型,相关性分别为0.9915和0.9474。在25 ℃和pH为5.0的条件下,针铁矿吸附Cd(Ⅱ)平衡时间为8 h左右,最大吸附量为35 mg/g左右;Cd (Ⅱ)浓度为50 mg/L时,针铁矿吸附Cd(Ⅱ)效率随pH升高而增大,当pH为7时,吸附效率达到100%;针铁矿在pH>3.0时,几乎不溶解;适用于一般生活污水的pH条件。CaCl2和MgCl2对针铁矿吸附Cd(Ⅱ)有抑制作用。
2)随着CaCl2浓度升高,针铁矿吸附Cd(Ⅱ)的最大吸附量由34.64 mg/g降至23.53 mg/g。随着MgCl2浓度升高,针铁矿吸附Cd(Ⅱ)的最大吸附量由36.11 mg/g 降至20.72 mg/g后,又升至24.10 mg/g。
[1] 杨杏芬, 吴永宁. 镉对人群健康效应研究需要注重肾损害水平之下的低剂量暴露[J]. 中华预防医学杂志, 2016, 50(4):292-295.
[2] 宣斌, 王济, 段志斌,等. 铅同位素示踪土壤重金属污染源解析研究进展[J]. 环境科学与技术, 2017(11):17-21.
[3] Wang X S. Cd (Ⅱ) removal by marine arthrobacter protophormiae biomass: mechanism characterization and adsorption performance[J]. Desalination and Water Treatment, 2013, 51(40/42): 7710-7720.
[4] Kresge C T, Leonowicz M E, Roth W J, et al. Ordered mesoporous molecular sieves synthesized by a liquid-crystal template mechanism[J].Nature,1992,359:710-712.
[5] Reddad Z, Gerente C, Andres Y, et al. Adsorption of several metal ions onto a low-cost biosorbent: kinetic and equilibrium studies[J].Environmental Science & Technology, 2002, 36(9): 2067-2073.
[6] 韩立志, 凌瑶, 徐霞,等. 粉末活性炭对水中重金属离子的吸附性能研究[J]. 海南师范大学学报(自然科学版), 2017, 30(1):24-27.
[7] Gupta V K, Agarwal Shilpi, Saleh Tawfik A. Cadmium removal by combining the magnetic properties of iron oxide with adsorption properties of carbon nanotubes [J]. Water Research, 2011, 45(6): 2207-2212.
[8] 滕洪辉, 彭雪, 高彬,等. 碳材料吸附去除水体中镉离子研究进展[J]. 水处理技术, 2018, 44(4): 11-16.
[9] 马锋锋, 赵保卫, 刁静茹. 小麦秸秆生物炭对水中Cd2+的吸附特性研究[J]. 中国环境科学, 2017, 37(2):551-559.
[10] 刘慧, 朱霞萍, 付小君,等. 镉在蒙脱石上的吸附解吸动力学与热力学研究[J]. 矿产综合利用, 2013(1):73-77.
[11] 朱立超, 刘元元, 李伟民,等. 施氏矿物的化学合成及其对含Ce(Ⅵ)地下水吸附修复[J]. 环境科学, 2017, 38(2):629-639.
[12] 谢水波, 冯敏, 杨金辉,等. 腐殖酸改性针铁矿对铀U(Ⅵ)的吸附性能及机理研究[J]. 环境科学学报, 2014, 34(9): 2271-2278.
[13] 任天昊, 杨琦, 李群,等. 针铁矿对废水中Cr(Ⅵ)的吸附[J]. 环境科学与技术, 2015,38(增刊2):72-77.
[14] 张继义,梁丽萍,蒲丽君,等.小麦秸秆对 Cr(Ⅵ)的吸附特性及动力学、热力学分析[J].环境科学研究,2010,23(12):1546-1552.
[15] Leyva-Ramos R, Rangel-Mendez J R, Mendoza-Barron J, et al. Adsorption of cadmium (Ⅱ) from aqueous solution onto activated carbon [J].Water Science and Technology, 1997,35(7):205-211.
[16] Obreg n-Valencia D, Sun-kou M D R. Comparative cadmium adsorption study on activated carbon prepared from aguaje (Mauritia flexuosa) and olive fruit stones (Olea europaea L.) [J].Journal of Environmental Chemical Engineering,2014,2(4): 2280-2288.
n-Valencia D, Sun-kou M D R. Comparative cadmium adsorption study on activated carbon prepared from aguaje (Mauritia flexuosa) and olive fruit stones (Olea europaea L.) [J].Journal of Environmental Chemical Engineering,2014,2(4): 2280-2288.
[17] Asuquo E, Martin A, Nzerem P, et al. Adsorption of Cd(Ⅱ) and Pb(Ⅱ) ions from aqueous solutions using mesoporous activated carbon adsorbent: equilibrium, kinetics and characterisation studies [J].Journal of Environmental Chemical Engineering,2017,5 (1): 679-698.
[18] 徐楠楠, 林大松, 徐应明,等. 玉米秸秆生物炭对Cd2+的吸附特性及影响因素[J]. 农业环境科学学报, 2014, 33(5):958-964.
[19] 朱志良, 孔令刚, 马红梅, 等. 2种羟基氧化铁对水中Cr(Ⅵ)的吸附性能[J]. 应用化学, 2007, 24(8): 933-936.
[20] 王未平, 戴友芝, 贾明畅, 等. 磁性海泡石表面零电荷点和吸附Cd2+的特性[J]. 环境化学, 2012, 31(11): 1691-1696.
[21] Lehmann J. Bio-energy in the black[J]. Frontiers in Ecology and the Environment, 2007, 5:381-387.
[22] 李力, 陆宇超, 刘娅, 等. 玉米秸秆生物炭对 Cd(Ⅱ)的吸附机理研究[J]. 农业环境科学学报, 2012, 31(11):2277-2283.
[23] Filius J D,Lumsdon D G,Meeussen J C L,et al. Adsorption of fulvic acid on goethite[J]. Geochimica Cosmochimica Acta,2000,64(1): 51-60.