1 概 述
纳米电解池(nanogap electrochemical cells,NECs)是一种电极间距为微米甚至纳米级别的电解池装置[1]。NECs最早起源于电化学检测的需要,扫描电化学显微镜就是1种典型的NECs结构。近年来,随着光刻技术的发展以及人们对NECs的关注,NECs发展出了更多的构型及用途。
图1所示为不同尺寸电化学体系内电流分布。可知:在传统宏观电解体系中,电极间距远大于体系德拜长度,体系中2个半反应分离,扩散(受溶液浓度梯度限制)成为反应中的速率限制步骤。当电极间距逐渐减小至德拜长度时,反应变为迁移限制(受电场强度限制)。由于以上2种体系的反应速率都受限于质量传输速率,所以都无法达到固定电压下的饱和电流。而在NECs中,电极间距减小至德拜长度以下时,两电极间的扩散层消失,双电层重叠,从而在两电极间形成1个强电场,加速溶液中离子的转移,电流达到饱和,使得电化学反应由传质控制变为传荷控制。因此,NECs可以使低电导率电解液甚至纯水发生电解反应[2],而且对于电信号有明显的放大作用[3-4],这对于单分子电化学以及电化学双层效应的研究有着重要意义[1]。这些特点使得NECs在电化学分析、低电导率废水处理以及纳米储能材料[5]等方面有着很好的前景。本文基于文献对NECs进行综述,重点介绍NECs的制备及其在不同领域的应用。

图1 不同尺寸电化学体系内电流分布[2]
Fig.1 Current distribution of electrochemical systems with different size[2]
2 纳米电解池的制备
NECs根据制备方法可分为3类:电化学法NECs、光刻法NECs以及其他方法制备的NECs。
2.1 电化学法纳米电解池
电化学方法制作NECs主要通过电化学沉积和电化学刻蚀来实现,通过控制操作过程中的溶液浓度、操作时间等来得到目标电极间距与电解池构型。如图2所示,电化学刻蚀通过恒电位下电流的变化来对刻蚀过程进行监控,同时也可以在电沉积过程中通过电流变化的精确控制获得目标的电极间距[6]。

图2 玻璃基底上的纳米金属线NECs示意[6]
Fig.3 Schematic drawing of the metal wires NECs supported
by a glass substrate[6]
Liu等[7]用电化学合成制作A-B-A三段式金属纳米线,再采用电化学刻蚀或加热的方式去除B段后得到NECs,并在此基础上制作出有机场效应晶体管。而电化学刻蚀再辅以电化学沉积,可以在极小范围内实现电极间距的精确控制[8]。Liu等[9]通过计时电势分析法优化电化学沉积过程,成功地将金电极对的间距由纳米级降至埃米级,该方法不仅进一步缩小了电极间距,而且对于实现微芯片上纳米装置的高效快速制作有重要意义。但是,当电极间距进一步减小时,也会有其他问题伴随出现。例如,电沉积过程中随着电极间距的减小而出现的自我抑制溶剂消耗现象(self-inhibited reagent depletion,SIRD)[10]。对于镍电极,当电极间距接近1 nm时会出现遂穿电流-电压的不对称性,Valladares等[11]对此提出外加磁场会增加镍纳米电极的导电性,对I-U曲线有一定的修正作用。于是,外加磁场作为一种辅助手段出现在NECs的电沉积制备过程中[12]。
电化学方法制备NECs可以实现纳米甚至埃米级的电极间距,并且具有过程可逆、操作简单及经济性良好等优点,可以在大面积粗糙表面有选择性地形成光滑薄膜[13]。但是,电沉积金属离子的结晶度不同会导致电极边缘线的粗糙度不同,对NECs的性能有不利影响[14]。而且,由于电化学法NECs构型较为单一,导致其应用目前也仅限于分子电子学方面的研究。但电化学法所能实现的纳米甚至埃米级的电极间距相对于其他方法而言是独一无二的优势。鉴于此,可以考虑将电化学法与其他方法相结合,从而拓宽电化学法NECs应用范围,同时也可以将NECs在其他领域的研究由应用层面的优化深入到机理方面的探索。
2.2 光刻法纳米电解池
光刻技术在NECs制备中扮演着重要角色,常见的光刻方法有传统光刻技术、聚焦离子束刻蚀(focus ion beam,FIB)、电子束光刻(electron beam lithography,EBL)等。传统光刻技术是一种利用类似于照相复制的曝光与刻蚀相结合的技术,通过曝光和显影工序把集成电光刻掩模板的版图图形转移到光刻胶上,然后通过刻蚀工艺再转移到基片(如硅片)上,在基片表面生成微、纳米尺度的集成电路图形层。而作为新型光刻技术的FIB和EBL则通过电场和磁场的作用,控制电子束和聚焦离子束,在基片上扫描出理想的图形[15]。相比于单纯电化学技术,光刻技术使NECs有了更多样化的构型。
在光刻技术制备NECs的过程中,通常还需要其他化学方法的共同参与。Ngoc等[16]将光刻与气相沉积相结合,制作出由金属纳米线组成的可变电极间距的NECs。Partel等[17]采用聚合物热模压与光刻结合来制作三维交叉纳米电解池阵列(3D nanogap interdigitated electrode array,3D-IDA)。Singh等[18]利用反应性粒子刻蚀制备3D-IDA,并以电化学交流阻抗谱作为检测手段,分别进行了C反应蛋白及抗组织谷氨酰胺转移酶的检测,并通过添加Au粒子标记,达到与酶联反应吸附测定法相同的测定灵敏度。Zafarani等[19]通过两步电子束光刻制作出开放式NECs,这种构型可以用于光电分子特性的综合检测。Yu等[20-21]利用电子束光刻与分子自组装相结合制备超灵敏杂交纳米生物传感器,并应用于生物素-链霉亲和素的检测,检测限可达1 pmol/L。Hatanaka等[22]利用光刻技术与电化学刻蚀相结合制作出电极间距<10 nm的NECs,并将其用于低聚噻吩网格的电导率测定。
纳米传感器响应信号不仅受到电极间距影响,也会受到电极面积影响,特别是在分析物浓度较低时[23-24]。光刻技术所制备的NECs阵列本质上就是对于电极面积的一种放大。Han等[25]利用FIB制备双环阵列纳米电解池,使法拉第电流实现约65倍放大,这种构型可通过改变孔排列密度来改变电流放大倍数。
光刻方法制备NECs的主要优点在于可以实现NECs的批量制作,但对于NECs尺寸及形貌的精细控制,光刻技术相比于传统化学法并不占优势。传统光刻技术中存在定位公差,所以牺牲层面积必须大于底部电极面积,导致电解池中会出现死区(上下两电极未完全重合的部分),如图3所示,从而导致电信号损失[26]。而且由于光刻技术本身的限制,光刻法NECs无法实现纳米甚至埃米级的电极间距。虽然对于电化学检测来说,光刻法所能实现的电极间距已经非常精细,但对于电化学双层研究以及均相、非均相反应机制研究等方面来说还远远不够。因此,以光刻法实现各种构型的变化并以电化学法来实现尺寸及形貌上的精细控制,将会是一种比较理想的NECs制备方式。

图3 NECs制备过程中的理想形态与死区问题示意[26]
Fig.3 Schematic of ideal geometry of the nanogap device, and a
nanogap device with dead volumes[26]
2.3 其他方法制备的纳米电解池
Dale等[27]将厚度100 nm的金薄片利用Ti附着层黏在载玻片上,再将2片覆有金薄片的载玻片以金片相对形式压合,中间夹多功能环氧树脂来起到隔离两电极及控制电极间距的作用。制得的NECs电极间距约为2.8 μm,这种制作工艺方法简单方便且材料易得,具有较好的经济性。
Park等[28]利用大小统一的特定微粒来制作NECs。将微粒夹在两电极之间,再将两电极从外部固定起到分隔与控制电极间距的作用。这种方法有较好的经济性且技术难度较低,可用于大规模生产,通过这种方法可在500 nm~8 μm内精确地控制并改变电极间距,并且可以制备较大面积的电极。将这种电解池应用于生物检测器,实现了在干扰物质(抗坏血酸)存在的情况下对多巴胺进行选择性检测。
Adly等[29]利用3D喷墨打印技术制作了1种三维多层纳米多孔电解池。这种纳米多孔电解池主要是基于由碳纳米墨水和金纳米墨水构成的两电极的垂直堆叠,两电极间由聚苯乙烯纳米微球填充起到分隔作用。利用喷墨打印技术可以实现对内电极间距在百纳米级别的精细控制,这种电解池在电化学检测方面有极好的表现。以二茂铁二甲醇作为氧化还原活性探针时,可以实现100%的捕获率及30倍左右的信号放大。这种方法在电化学精确检测方面相较于复杂的光刻技术具有成本低廉、通用性强的特点。
3 纳米电解池应用
3.1 电化学检测
单分子电化学检测是电分析化学中一个极具挑战性的方面,需要新型的精细结构电解池及检测手段[3],NECs也应运而生。目标物分子通过微米甚至纳米级的电解池间隙,在其中发生极快的氧化还原反应,相较于宏观电解池有数十倍的电信号放大,并且当电极间距小于体系电化学双电层厚度时,电容型检测器的电容与离子强度的相关性可以被忽略,使得单分子电化学检测的灵敏度与准确度都得到了极大提高[30]。
Shen等[31-32]研究表明,扫描电化学显微镜(scanning electrochemical microscopy,SECM)结构可达到纳米级的间距,所以早期单分子电化学检测主要是基于SECM结构来展开的。Byers等[3]制作的箱式探针纳米电解池,采用了类SECM结构,当有目标物质通过两电极间隙时,电信号被明显放大,从而可以实现实时连续检测,尤其适用于单分子电化学检测。纳米级SECM不仅可以用于均相、非均相反应研究,也可应用于电极表面纳米粒子大小的测量。相比于其他电子及光学测试方法,SECM无需面对衍射影响和高能耗的问题,具有更广泛的使用范围[33]。将类SECM检测器与有限元分析结合,可以实现快速电子转移动力学的高效检测,以及对于纳米材料电化学活性机理方面的探索[34-35]。类SECM检测器在纳米领域应用的关键在于对探针与基底间距离实现纳米级范围内的精确控制,但环境温度改变导致的SECM内部器件热膨胀及收缩会对电极间距产生明显影响[36]。
由于这种构型在大范围应用上的局限性,又出现了纳米传感器类的相关研究,二者的典型结构如图4所示[37]。Guo等[38]将纳米电化学传感器用于环境样品中Hg2+的特异性检测,检测限可达到1 nmol/L。除了检测限降低外,相比于传统微电解池,纳米电化学传感器的极限电流不会再受到通道内样品流速的影响,可以实现超低流速流体(<10 pL/min)的检测[39-40]。与此同时,高的水平流速则可以大幅提高纳米传感器的响应速度[41]。但由于布朗运动的特性,随机性问题仍然普遍存在于单分子电化学检测中,Singh等[42]通过实验证实并以水平流的方式克服了随机性问题。
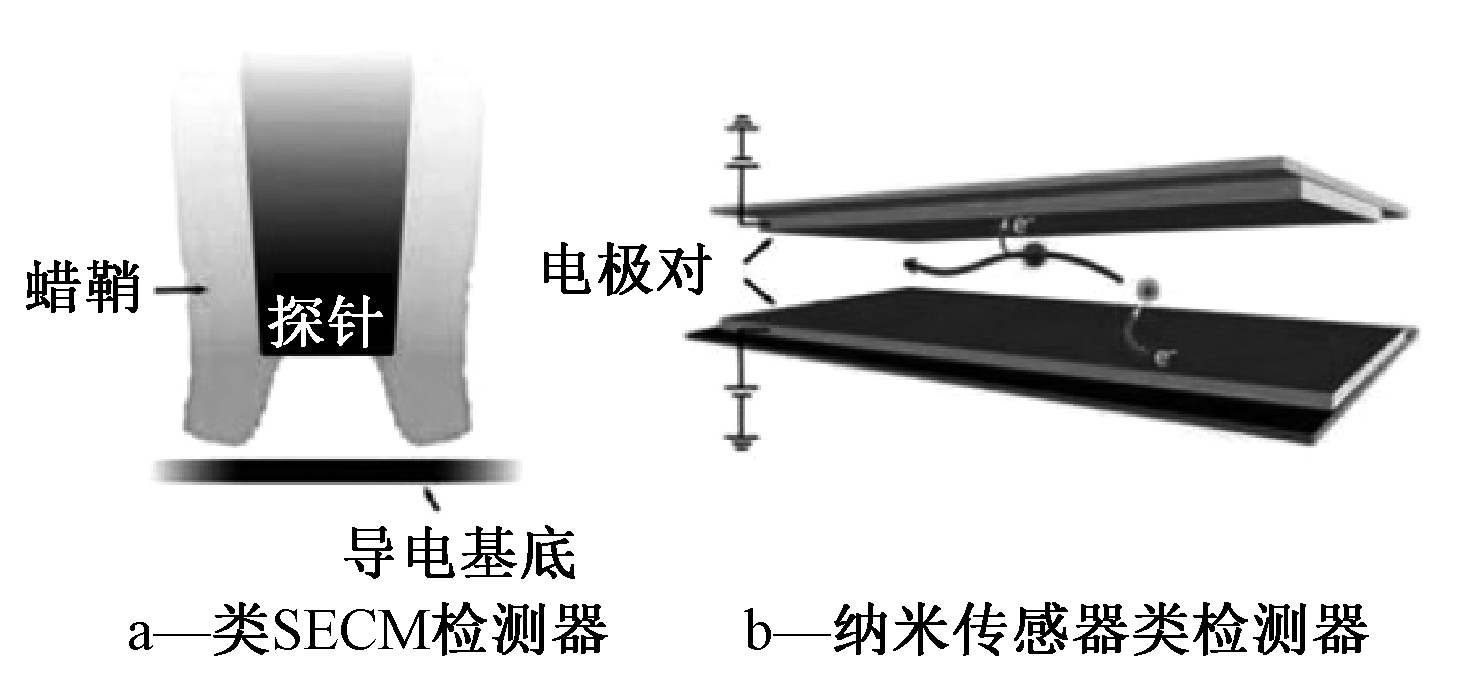
图4 类SECM检测器与纳米传感器类检测器示意[37]
Fig.4 Schematic of the SECM-like detector and nano-transducer
单分子电化学检测不仅依赖于传感器构型的改进,分析模型与方法的建立和优化也非常重要[43]。例如,当多种氧化还原物质共存时,调节特定电压使特定物质发生氧化还原反应就可以排除互相之间电信号干扰实现特异性检测[44]。而NECs与电化学阻抗谱的结合在纳米级基础研究和表面非标记特异性检测方面展现出广泛的应用前景[45]。
单分子电化学检测主要应用在生物领域,尤其以DNA检测方面的应用为代表。Lee等[46]利用DNA单链与DNA双链介电性能的不同,将纳米电容器作为DNA微阵列传感器来进行非标记DNA的杂交检测。Bi等[47]利用SECM第1次以电化学方法检测到鸟嘌呤核苷(Gs)的电致中间产物,这种中间产物的生命周期只有不到40 μs,这一技术使得对于之前其他电化学方法无法捕捉到的核苷的研究成为可能。Roy等[48]利用光刻与电化学刻蚀相结合制作的DNA定量纳米检测器,利用目标DNA与电极表面固定生物探针的杂交对于电导率的改变,实现了飞摩尔级的DNA检测。Kim等[49]验证了内嵌纳米间距的互补性金属氧化物半导体(nanogap embedded complementary metal oxide semiconductor,NeCMOS)对于非标记DNA序列检测的可行性,并提出在DNA检测方面,P型NeCMOS比N型NeCMOS具有更高的灵敏度。
此外还有细胞及酶学方面,Rattalino等[50-51]提出将NECs应用于葡萄糖的检测,这对于细胞培养的植入性装置直接监测以及临床诊断都有重要意义。Sekretaryova等[52]首次检测到单一氧化还原酶分子与超微电极碰撞产生的酶催化反应电流,并提出单分子酶学在于酶促反应机理研究上的潜力。Rassaei等[53]制作出体积仅6 pL的纳米电化学传感器,有望用于细胞内含物及细胞器的研究。
NECs的出现是由于电化学检测的需要,而目前已成为NECs最主要的应用领域,以生物检测为主,还有其他对于有机、无机分子的综合检测(如电导率测定、纳米粒子大小测定、电子快速转移动力学测定等)。随着NECs尺寸的进一步缩小,NECs在电化学检测上的应用将朝着低浓度高精度以及多目标物检测分析前进,从而推动其在临床诊断以及污染物快速检测等方面的大规模应用。
3.2 低电导率废水处理
面对低电导率废水处理,由于体系电阻过大导致电化学法面临的最大问题就是能耗过高,常规方法是以额外添加电解质来增加电导率降低体系电阻,但会导致额外的药剂成本,而将NECs引入低电导率废水处理则是通过缩小电极间距来降低体系电阻,不仅降低了运行成本,同时还不会引入额外的药剂成本。Ma等[54]研究了低电导实际废水的电化学处理,比较了传统宏观电解池(添加电解质与不添加电解质)以及NECs(不添加电解质)对于实际低电导率废水的处理效果和运行成本。结果表明:同样电流条件下,NECs对TOC的去除率比传统宏观电解池(不添加电解质)高9%。而NECs与传统宏观电解池(添加额外电解质)相比,处理效果虽然相仿,但后者需要更长的处理时间(更高的运行成本)。可以看出NECs在低电导率废水处理上有明显优势。目前NECs在这一方面的应用研究还很少,若能将NECs的概念引入电化学反应器的设计中(如管道式连续流电解过滤反应器),不仅可以实现运行成本以及药剂成本的优化,在实际工业化应用中,由于反应器体积的大幅减小还将实现基建成本的大大缩减,从而推动电化学法在实际废水处理中更广泛的应用。
3.3 电解水制氢
在能源结构急需转型的今天,氢能作为一种清洁能源载体有着广泛的发展前景。目前工业上制氢主要采用的是蒸汽重整制氢。电解水制氢由于其极高的能耗在实际应用中受到很大的限制。但Wang等[2]将NECs应用于电解水产氢,随着电极间距的减小,同一电压下纯水电解电流出现明显增加,且实验过程中有肉眼可见的气泡产生,可见借助NECs无需添加额外的电解质就可以有效地实现纯水电解。同时,在此基础上提出NECs体系中强电场辅助的纯水分解机制,即在实验所用NECs中,强电场虽然并未真正实现水分子的直接击穿,但由于体系中强电场的存在对于水的离子化以及溶液中的传质都有极大的加强,这种机制将可能成为推动电解水制氢在工业中应用的一个重要突破。
3.4 储能装置
NECs内部极度有限空间内的电化学双电层对于纳米多孔储能材料的离子转移有很大影响[55]。Guan等[56]将TiO2纳米管内包裹不同纳米棒应用于储能装置,并提出了其内部纳米间距在锂离子电池和燃料电池方面的可能应用。纳米间距中电化学双层的快速离子转移,对于储能装置的快速充电也有重要意义[57]。综上,对NECs的制备方法与应用进行总结,具体列于表1。
表1 几种NECs优缺点与应用总结
Table 1 Summary of several NECs’ advantages, disadvantages and their applications

制备方法最小电极间距优点缺点应用光刻法十纳米级技术成熟,可实现大批量生产无法实现纳米级的精细控制电化学检测[17-21, 23, 25, 26, 38-47, 49-53]电解水制氢[2]储能装置[55]电化学法埃米级过程可逆,可达到埃米级电极间距构型单一分子电子学[6-9, 13, 14]电化学法&光刻法纳米级构型多样,过程可逆,可实现纳米级电极间距的精细控制目前研究较少电化学检测[22, 48]其他百纳米级制备过程简单,成本低廉无法实现纳米级的电极间距电化学检测[3, 27-29, 31-35]废水处理[54]储能装置[56, 57]
4 结论与展望
NECs作为一种全新电解池类型,具有完全不同于传统宏观电解池的电化学反应机制。在NECs的制备方面,电化学方法对于亚纳米级电极间距的实现以及电极表面形貌的精细控制有着很好的表现,而光刻技术则在NECs的大规模制作上更具实用性,如何实现二者的优化结合将是超精细NECs在大规模应用上必须要考虑的问题。在NECs的应用方面,虽然NECs最初的出现是源于单分子电化学检测的需要,但由于NECs极小的电极间距和强化的电化学反应机制,NECs在低电导率废水处理、电解水制氢、超级电容器等方面也显示出巨大的应用潜力与研究价值。关于NECs的应用,无论是构型的设计与优化,还是多样化的辅助分析方法都有很多值得探索的地方。同时,NECs精细的结构对于电化学检测中的数据分析过程也提出了更高的要求。
[1] White H S, McKelvey K. Redox cycling in nanogap electrochemical cells[J]. Current Opinion in Electrochemistry, 2018,7:48-53.
[2] Wang Y F, Narayanan S R, Wu W. Field-assisted splitting of pure water based on deep-sub-debye-length nanogap electrochemical cells[J]. Acs Nano, 2017,11(8):8421-8428.
[3] Byers J C, Nadappuram B P, Perry D, et al. Single molecule electrochemical detection in aqueous solutions and ionic liquids[J]. Analytical Chemistry, 2015,87(20):10450-10456.
[4] Tokue H, Kakitani K, Nishide H, et al. Redox Mediation through TEMPO-substituted polymer with nanogap electrodes for electrochemical amplification[J]. Chemistry Letters, 2017,46(5):647-650.
[5] Xiong J W, Chen Q J, Edwards M A, et al. Ion transport within high electric fields in nanogap electrochemical cells[J]. Acs Nano, 2015,9(8):8520-8529.
[6] He H X, Boussaad S, Xu B Q, et al. Electrochemical fabrication of atomically thin metallic wires and electrodes separated with molecular-scale gaps[J]. Journal of Electroanalytical Chemistry, 2002,522(2):167-172.
[7] Liu S H, Tok J B H, Bao Z N. Nanowire lithography: fabricating controllable electrode gaps using Au-Ag-Au nanowires[J]. Nano Letters, 2005,5(6):1071-1076.
[8] Chen F, Qing Q, Ren L, et al. Electrochemical approach for fabricating nanogap electrodes with well controllable separation[J]. Applied Physics Letters, 2005,86(12):123105.
[9] Liu B, Xiang J, Tian J H, et al. Controllable nanogap fabrication on microchip by chronopotentiometry[J]. Electrochimica Acta, 2005,50(15):3041-3047.
[10] Lam B, Zhou W D, Kelley S O, et al. Programmable definition of nanogap electronic devices using self-inhibited reagent depletion[J]. Nature Communications, 2015,6:6940.
[11] Valladares L, Felix L L, Dominguez A B, et al. Controlled electroplating and electromigration in nickel electrodes for nanogap formation[J]. Nanotechnology, 2010,21(44):445304.
[12] Xie S L, Gou J X, Yang Z N. In situ growth of nanowires and fabrication of nanogap electrode pairs by selective chemical deposition with the assistance of an external magnetic field[J]. Journal of Nanoscience and Nanotechnology, 2015,15(5):3994-3997.
[13] Kobayashi C, Wakayama Y, Shirai Y, et al. Fabrication of nanogap electrodes by enhancing lateral growth of au electrodeposition for electrical property measurement of organic nanowires[J]. Electrochemistry, 2013,81(4):236-238.
[14] Kim J H, Moon H, Yoo S, et al. Nanogap electrode fabrication for a nanoscale device by volume-expanding electrochemical synthesis[J]. Small, 2011,7(15):2210-2216.
[15] 周辉, 杨海峰. 光刻与微纳制造技术的研究现状及展望[J]. 微纳电子技术, 2012,49(9):613-618,636.
[16] Ngoc L L T, Jin M L, Wiedemair J, et al. Large area metal nanowire arrays with tunable Sub-20 nm nanogaps[J]. Acs Nano, 2013,7(6):5223-5234.
[17] Partel S, Kasemann S, Matylitskaya V, et al. A simple fabrication process for disposable interdigitated electrode arrays with nanogaps for lab-on-a-chip applications[J]. Microelectronic Engineering, 2017,173:27-32.
[18] Singh K V, Whited A M, Ragineni Y, et al. 3D nanogap interdigitated electrode array biosensors[J]. Analytical and Bioanalytical Chemistry, 2010,397(4):1493-1502.
[19] Zafarani H R, Mathwig K, Sudholter E J R, et al. Electrochemical amplification in side-by-side attoliter nanogap transducers[J]. Acs Sensors, 2017,2(6):724-728.
[20] Yu Y, Chen X, Wei Y, et al. CdSe quantum dots enhance electrical and electrochemical signals of nanogap devices for bioanalysis[J]. Small, 2012,8(21):3274-3281.
[21] Lu Y, Guo Z, Song J J, et al. Tunable nanogap devices for ultra-sensitive electrochemical impedance biosensing[J]. Analytica Chimica Acta, 2016,905:58-65.
[22] Hatanaka N, Endo M, Okumura S, et al. Electrical conductance measurement of oligothiophene molecular wires using nanogap electrodes prepared by electrochemical plating[J]. Chemistry Letters, 2007,36(2):224-225.
[23] Hammond J L, Rosamond M C, Sivaraya S, et al. Fabrication of a horizontal and a vertical large surface area nanogap electrochemical sensor[J]. Sensors, 2016,16(12):2128.
[24] Zafarani H R, Mathwig K, Sudholter E J R, et al. Electrochemical redox cycling in a new nanogap sensor: design and simulation[J]. Journal of Electroanalytical Chemistry, 2016,760:42-47.
[25] Han D, Zaino L P, Fu K, et al. Redox cycling in nanopore-confined recessed dual-ring electrode arrays[J]. The Journal of Physical Chemistry C, 2016,120(37):20634-20641.
[26] Kang S, Nieuwenhuis A, Mathwig K, et al. Electrochemical single-molecule detection in aqueous solution using self-aligned nanogap transducers[J]. Acs Nano, 2013,7(12):10931-10937.
[27] Dale S E, Chan Y, Bulman Page P C, et al. A gold-gold oil microtrench electrode for liquid-liquid anion transfer voltammetry[J]. Electrophoresis, 2013,34(14):1979-1984.
[28] Park S, Park J H, Hwang S, et al. Bench-top fabrication and electrochemical applications of a micro-gap electrode using a microbead spacer[J]. Electrochemistry Communications, 2016,68:76-80.
[29] Adly N Y, Bachmann B, Krause K J, et al. Three-dimensional inkjet-printed redox cycling sensor[J]. RSC Advances, 2017,7(9):5473-5479.
[30] Li Z, Jayatissa A H, Mapa L, et al. Electrochemical sensors for detection of biomolecules[C]//2009 Ieee International Conference On Electro/Information Technology. Windsor,2009.
[31] Shen M, Arroyo-Curras N, Bard A J. Achieving nanometer scale tip-to-substrate gaps with micrometer-size ultramicroelectrodes in scanning electrochemical microscopy[J]. Anal Chem, 2011,83(23):9082-9085.
[32] Chen R, Balla R J, Li Z T, et al. Origin of asymmetry of paired nanogap voltammograms based on scanning electrochemical microscopy: contamination not adsorption[J]. Analytical Chemistry, 2016,88(16):8323-8331.
[33] Kai T H, Zoski C G, Bard A J. Scanning electrochemical microscopy at the nanometer level[J]. Chemical Communications, 2018,54(16):1934-1947.
[34] Tan S Y, Zhang J, Bond A M, et al. Impact of adsorption on scanning electrochemical microscopy voltammetry and implications for nanogap measurements[J]. Analytical Chemistry, 2016,88(6):3272-3280.
[35] Amemiya S, Chen R, Nioradze N, et al. Scanning electrochemical microscopy of carbon nanomaterials and graphite[J]. Accounts of Chemical Research, 2016,49(9):2007-2014.
[36] Kim J, Shen M, Nioradze N, et al. Stabilizing Nanometer Scale Tip-to-Substrate Gaps in Scanning Electrochemical Microscopy Using an Isothermal Chamber for Thermal Drift Suppression[J]. Analytical Chemistry, 2012,84(8):3489-3492.
[37] Lemay S G, Kang S, Mathwig K, et al. Single-molecule electrochemistry: present status and outlook[J]. Accounts of Chemical Research, 2013,46(2):369-377.
[38] Guo Z, Liu Z G, Yao X Z, et al. A molecular-gap device for specific determination of mercury ions[J]. Scientific Reports, 2013,3:3115.
[39] Mathwig K, Mampallil D, Kang S, et al. Electrical cross-correlation spectroscopy: measuring picoliter-per-minute flows in nanochannels[J]. Physical Review Letters, 2012,109(11):118302.
[40] Rassaei L, Mathwig K, Goluch E D, et al. Hydrodynamic voltammetry with nanogap electrodes[J]. The Journal of Physical Chemistry C, 2012,116(20):10913-10916.
[41] Mathwig K, Lemay S G. Mass transport in electrochemical nanogap sensors[J]. Electrochimica Acta, 2013,112:943-949.
[42] Singh P S, Katelhon E, Mathwig K, et al. Stochasticity in single-molecule nanoelectrochemistry: origins, consequences, and solutions[J]. Acs Nano, 2012,6(11):9662-9671.
[43] Nair P R, Alam M A. A compact analytical formalism for current transients in electrochemical systems[J]. Analyst, 2013,138(2):525-538.
[44] Zafarani H R, Mathwig K, Lemay S G, et al. Modulating selectivity in nanogap sensors[J]. Acs Sensors, 2016,1(12):1439-1444.
[45] Fini H S, Suganuma Y, Dhirani A A. Microfabricated, silicon devices with nanowells and nanogap electrodes: a platform for dielectric spectroscopy with silane-tunable response[J]. Materials Research Express, 2015,2(5):055012.
[46] Lee J S, Choi Y K, Pio M, et al. Nanogap capacitors for label free DNA analysis[J]. Biomems and Bionanotechnology, 2002,729:185-190.
[47] Bi S P, Liu B, Fan F R F, et al. Electrochemical studies of guanosine in DMF and detection of its radical cation in a scanning electrochemical microscopy nanogap experiment[J]. Journal of the American Chemical Society, 2005,127(11):3690-3691.
[48] Roy S, Chen X J, Li M H, et al. Mass-produced nanogap sensor arrays for ultrasensitive detection of DNA[J]. Journal of the American Chemical Society, 2009,131(34):12211-12217.
[49] Kim C H, Jung C, Lee K B, et al. Label-free DNA detection with a nanogap embedded complementary metal oxide semiconductor[J]. Nanotechnology, 2011,22(13):135502.
[50] Rattalino I, Motto P, Taurino I, et al. Nanogap-based enzymatic-free electrochemical detection of glucose[C]//2013 Ieee Biomedical Circuits And Systems Conference. Rotterdam,2013.
[51] Balakrishnan S R, Hashim U, Letchumanan G R, et al. Development of highly sensitive polysilicon nanogap with APTES/GOx based lab-on-chip biosensor to determine low levels of salivary glucose[J]. Sensors And Actuators A: Physical, 2014,220:101-111.
[52] Sekretaryova A N, Vagin M Y, Turner A P, et al. Electrocatalytic currents from single enzyme molecules[J]. Journal of the American Chemical Society, 2016,138(8):2504-2507.
[53] Rassaei L, Mathwig K, Kang S, et al. Integrated biodetection in a nanofluidic device[J]. Acs Nano, 2014,8(8):8278-8284.
[54] Ma P, Ma H, Sabatino S, et al. Electrochemical treatment of real wastewater. Part 1: effluents with low conductivity[J]. Chemical Engineering Journal, 2018,336:133-140.
[55] Chen Q J, McKelvey K, Edwards M A, et al. Redox cycling in nanogap electrochemical cells: the role of electrostatics in determining the cell response[J]. The Journal of Physical Chemistry C, 2016,120(31):17251-17260.
[56] Guan C, Xia X H, Meng N, et al. Hollow core-shell nanostructure supercapacitor electrodes: gap matters[J]. Energy & Environmental Science, 2012,5(10):9085-9090.
[57] Parida K, Bhavanasi V, Kumar V, et al. Fast charging self-powered electric double layer capacitor[J]. Journal of Power Sources, 2017,342:70-78.