0 引 言
好氧颗粒污泥(aerobic granular sludge,AGS) 是在特殊物理化学条件下,微生物自聚集形成的颗粒状微生物聚集体。与传统活性污泥技术相比,好氧颗粒污泥具有沉降速度快、污泥浓度高、抗冲击负荷强、多功能微生物分层定殖等特点,因而具有占地面积少、运行成本低、可处理有毒废水及同步脱氮除磷等优势[1]。到目前为止,世界范围内对AGS的特性、形成条件、影响因素、微生物类型以及水质类型等方面开展了大量深入研究,研究成果为AGS的工程应用提供了重要的理论基础。但从现有少量的实际工程报道中发现,反应器启动周期长(5个月)且始终都存在一定比例的絮状污泥,表明AGS技术的实际工程应用并不乐观[2],同时AGS技术存在2个尚未解决的突出问题,即培养速度慢及颗粒解体问题。AGS技术还存在形成机理不确定、颗粒化标准不明确等问题,但缩短AGS培养周期显然是AGS技术需要解决的首要问题。本文通过对AGS形成的机理、好氧颗粒化的影响因素以及促进好氧颗粒化方法进行综述,明确加快好氧颗粒化的影响因素、操作参数以及有效的快速颗粒化方法,为后续AGS的快速培养提供参考。
1 好氧颗粒污泥的形成机理
AGS的形成机理是找出快速好氧颗粒化工艺和方法的关键。但AGS的形成过程复杂、影响因素多,到目前为止,其形成机理尚不明确。其中,选择压假说和四步理论是解释颗粒污泥形成机理中使用较多的理论。
1.1 选择压假说
选择压假说是从反应器运行的角度对好氧颗粒污泥形成机制进行解释。大量研究认为,选择压是AGS形成的最主要的驱动力[3]。好氧颗粒污泥是微生物为了应对外界环境变化而对自身生理机能所做的一种调节[4]。选择压假说就是通过改变操作条件等外界环境来逐渐淘汰掉接种污泥中或反应器中具有沉降慢、疏松、亲水等性状的部分污泥,而保留沉降快、致密、疏水等特性的污泥,即AGS,从而实现颗粒化。水力剪切力高、沉淀时间短、基质富裕与缺乏交替操作条件是SBR反应器中促进好氧颗粒化的3个基本条件[1,5]。选择压假说则是通过改变操作条件,来满足上述条件。当然,该假说主要侧重于颗粒化过程中污泥的物理特性变化,而未考虑颗粒内生物变化所产生的影响。
1.2 四步理论
Liu等[6]在各种单一假说的基础上,提出好氧颗粒污泥形成过程的四步理论:第1步,细胞相互移动并接触,细胞的移动受到扩散作用、剪切力、重力、热力学作用力以及细胞移动的作用;第2步,相互接触的细胞在外力作用下形成稳定的初始颗粒聚集体,其中外力包括物理作用力、化学作用力和生物化学作用力;第3步,微生物作用力促使微粒逐渐成熟,如分泌胞外聚合物(EPS)、细胞集群生长,以及环境刺激导致细菌的新陈代谢和基因表达变化;第4步,外界水力剪切力稳固颗粒的三维结构。
AGS形成机理的常见解释还包括微生物的自凝聚假说、疏水性假说、丝状菌假说、胞外聚合物(EPS)假说以及晶核假说,四步理论是在总结上述假说的基础上,对AGS的形成机理进行归纳和总结,从而能更好的解释颗粒化现象。
2 促进好氧颗粒化的可控参数
好氧颗粒化,是指通过控制相关条件且不使用任何载体材料,把松散的接种物转化为沉降性能良好的紧密颗粒的过程[7]。迄今为止,AGS的培养基本通过操作参数的改变来影响其内部微生物群落的种类和功能变化,从而促进颗粒化。可控参数主要包括接种污泥、基质成分、有机负荷、进水策略、反应器类型和水力条件、沉降时间、换水率以及曝气强度。
2.1 反应器类型
SBR反应器(图1)本身运行的特点使其较易培养出AGS。在SBR 系统里,不需要二次沉池,所有过程都在同一个反应器内进行。但SBR反应器处理能力有限,多用于小型污水处理厂。鉴于好氧颗粒污泥的优势,污水处理领域也尝试在现有污水处理工艺基础上应用该技术,即在连续流反应器里培养AGS。尽管连续流反应系统也有培养出AGS的少量报道,但培养难度大,并且在运行过程中容易出现AGS解体,所以SBR反应器仍是AGS培养的主流反应器[1]。因此,本文AGS影响参数主要针对SBR反应器条件下培养的AGS进行讨论。
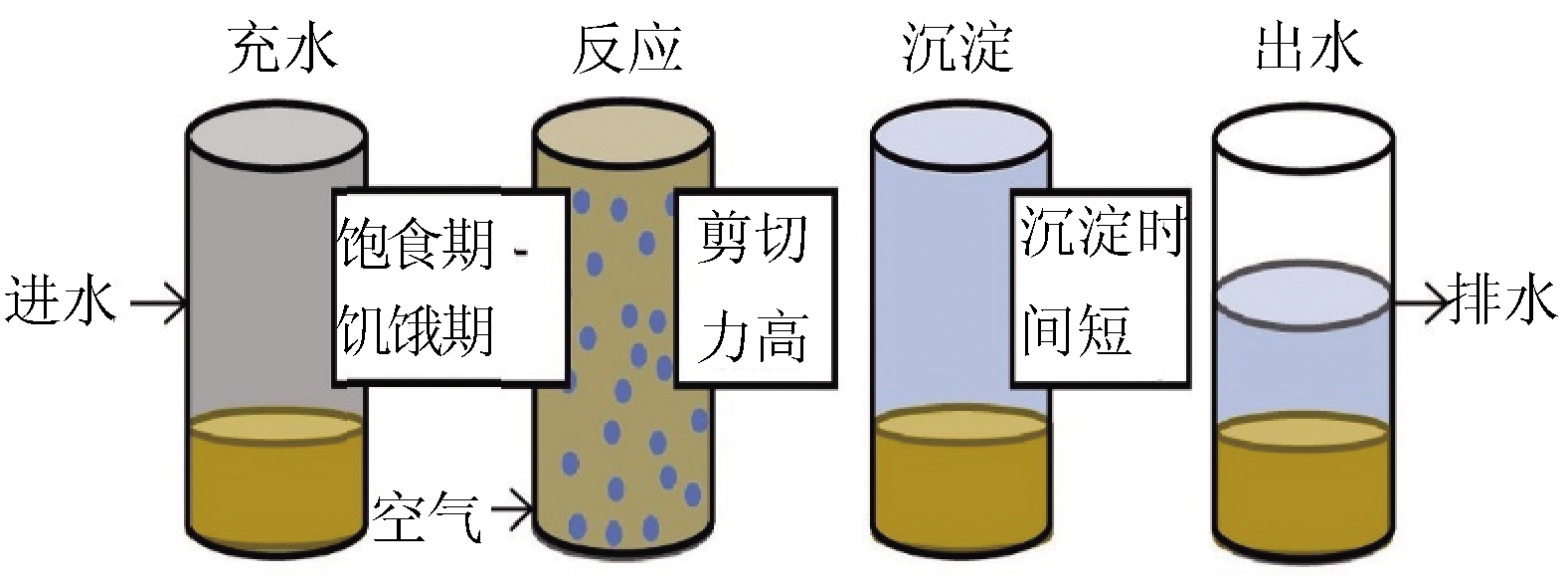
图1 SBR反应器的运行阶段[8]
Figure 1 Schematic representation of SBR operational stages[8]
2.2 接种污泥
活性污泥作为生物法处理废水中培养AGS的主要接种物。Zita等[9]发现,亲水性微生物不易黏附在活性污泥上,而疏水性微生物则相反。这种差异可能是由特殊物种或菌株造成的,也可能是某些细胞活动的结果[10]。Wilén等[11]发现,接种污泥中含有大量疏水性物质时好氧颗粒化更快实现且形成的颗粒污泥沉降性能良好。Adav等[12]从好氧颗粒污泥中分离出9种微生物,发现每种微生物的自凝聚性不同,且自凝聚性与有机负荷有关,当有机负荷增大到一定值时,AGS开始解体且大部分微生物自凝聚性降低。Yang等[13]发现以真菌作为接种物比以细菌作为接种物能更快形成AGS,但其培养出来的颗粒污泥结构松散且强度较差。张子健等[14]接种完全自养硝化污泥到SBR反应器里,第43天就获得直径为0.5 mm的成熟AGS。同样条件下,Liu等[15]用传统活性污泥作为接种物实现好氧颗粒化却用了400 d。尽管接种污泥对好氧颗粒化的影响尚无定论,但接种污泥中微生物类型及结构的差异,必然造成其在EPS的分泌量、细胞的疏水性以及凝聚性等方面的区别,从而导致好氧颗粒化速度的差异。
2.3 有机负荷
Hamza等[16]利用SBR反应器,在高浓度有机废水条件下以回流活性污泥培养AGS,经过4周完全实现颗粒化,并且在100 d内反应器都表现出良好的污染物去除能力及沉降性能。同样,Chen等[17]发现,在COD有机负荷为15 kg/(m3·d),在高曝气率条件下,好氧颗粒污泥也能够稳定运行。Zhang等[18]以活性污泥作为接种污泥,发现反应器启动初期高有机负荷[5.5 kg/(m3·d)]条件下,35 d可实现好氧颗粒化,并且拥有密实的结构、更高的强度和更大粒径,其平均粒径为550 mm,而在有机负荷为3.5 kg/(m3·d)培养下的颗粒污泥,颗粒化速度慢、强度低、粒径小。对颗粒中的微生物群落观察发现,初期高有机负荷下更容易富集大量分泌EPS的功能菌,而更多的EPS为好氧颗粒污泥提供了更多好氧颗粒污泥造粒基质[18]。高有机负荷可以促进AGS的快速形成,AGS速度与后续颗粒的稳定运行无关,AGS运行稳定性主要取决于反应器的操作参数[19]。
2.4 基质类型
基质类型对AGS外形、结构以及微生物种类有较大影响[20]。葡萄糖培养AGS结构疏松,表面主要以丝状菌为主,醋酸培养的AGS结构紧密,表面则主要以杆菌为主,表明高能量基质易于诱发丝状菌的繁殖[8]。Moy等[21]研究表明,相对复杂的有机物,降解需要多个步骤,可使AGS出现分层现象、复杂的微生物结构以及更多的微生物多样性,而简单基质条件下,易形成简单、单一的AGS生物结构。因此,不同基质降解利用途径不同,相应微生物类型和结构就有区别,进而导致污泥EPS的分泌、细胞疏水性等特性的差异,最终导致好氧颗粒化速度的差异。Wosman等[22]使用苯酚作为单一基质与醋酸和苯酚作为基质进行对比研究,发现单一基质条件下,AGS出现得更早,这也表明基质类型影响了颗粒化速度。
2.5 剪切力
水力剪切力包括曝气强度、上升气流速度以及高径比(h/d),对AGS的结构、代谢、EPS的分泌及稳定性等都有着重要影响[1]。较高的高径比可延长循环流的路径,增大液压摩擦有利于微生物的聚集,从而促进好氧颗粒化。因此,SBR反应器的高径比基本都在10以上。当然,SBR反应器的高径比也可<10,甚至只有1,也能够培养出AGS,但需要更多的曝气量[1]。
曝气量要与系统内微生物的耗氧量相对应,曝气量过高运行成本增大,过低可导致丝状菌过度繁殖,无法形成颗粒。高曝气量能提供足够的水力剪切力,还能够抑制丝状菌的过度繁殖,保证好氧颗粒的稳定性[23,24]。Zhou等[25]发现,高曝气率不但可以加快AGS的形成速度,还有利于SBR反应器的长期稳定运行。如表1所示,在有机负荷、接种污泥以及基质类型等基本相同的条件下,表观气流速度(曝气量除以SBR反应器的横截面积)较小时AGS无法形成,较大时可形成沉降性能良好,但粒径较小的AGS,此种情况运行经济成本较高。但Devlin等[26]对相同表观气流速度下不同有机负荷对AGS颗粒化的影响研究发现,ρ(COD)<300 mg/L时,表观气流速度为0.41 cm/s时也可形成性能良好的颗粒污泥,但是当ρ(COD)>600 mg/L时,则无法实现颗粒化。
2.6 SBR反应器的运行周期及沉淀时间
SBR反应器的运行周期基本在4~12 h。运行周期<4 h可导致污泥大量排出,>12 h可导致基质缺乏,颗粒污泥无法形成[1]。逐渐减少沉降时间是SBR系统中AGS培养常用策略,通常实现好氧颗粒化后,沉降时间一般控制在2~10 min[29,30]。SBR反应器选择较短的沉降时间(<10 min)可以对微生物聚集体进行快速选择,迫使轻的絮状或沉降速度慢的污泥颗粒被洗出。Qin等[31]研究沉降时间(5,10,15,20 min)与AGS形成的关系时发现,SBR选用5 min沉降时间时,反应器内无絮状污泥,并形成性能良好的AGS,短的沉降时间能够促进细胞多糖分泌、细胞表面的疏水性以及微生物活性。
表1 表观气流速度对AGS的形成及稳定性影响
Table 1 Effect of ascending air velocity on the formation and stabilization of AGS
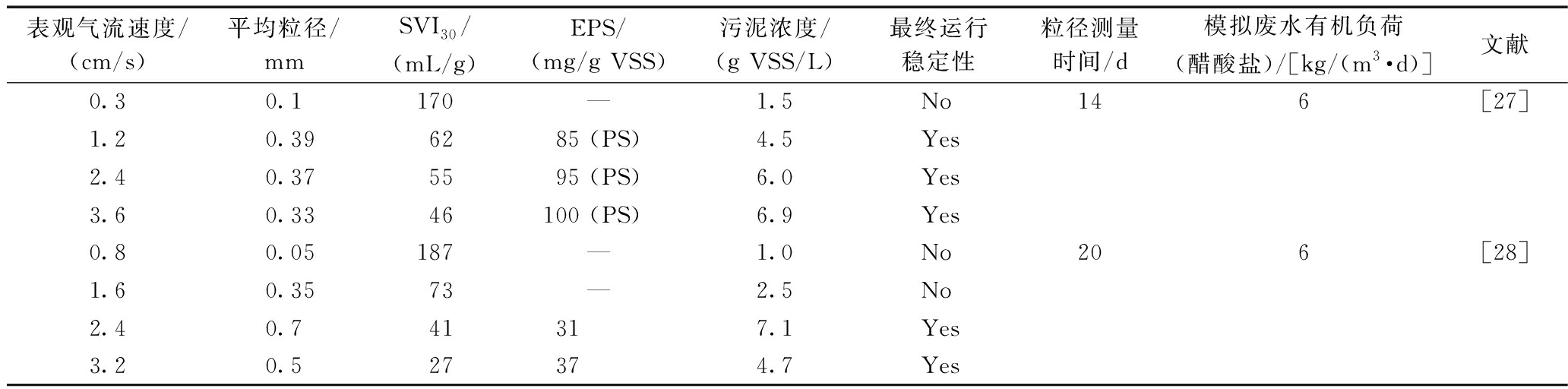
表观气流速度/(cm/s)平均粒径/mmSVI30/(mL/g)EPS/(mg/g VSS)污泥浓度/(g VSS/L)最终运行稳定性粒径测量时间/d模拟废水有机负荷(醋酸盐)/[kg/(m3·d)]文献0.30.1170—1.5No146[27]1.20.396285 (PS)4.5Yes2.40.375595 (PS)6.0Yes3.60.3346100 (PS)6.9Yes0.80.05187—1.0No206[28]1.60.3573—2.5No2.40.741317.1Yes3.20.527374.7Yes
2.7 饱食期与饥饿期
通过改变SBR反应器的运行周期可控制饥饿时间,研究发现较短的饥饿时间增大了生物选择压,有利于颗粒的形成但不利于AGS的稳定运行[32]。在实际操作中,颗粒的形成时间是反应器启动的决定因素,但是紧密的颗粒聚集体的形成时间至少需要2~4周,并且还需要1~2月才能发展成为成熟的AGS。所以,在反应器启动初期为了促进颗粒聚集体的快速形成可选择短的饥饿期,而稳定运行期则可选择较长的饥饿期。同时,过长的饥饿期可导致过多EPS消耗、高能量消耗以及反应器污水处理量的减少[33]。Liu 等[32]发现,饥饿期占曝气时间的40%时,好氧颗粒化加快,但会影响好氧颗粒污泥的稳定性。Wang等[34]发现,饥饿时间占曝气时间的20%时,能够形成密实且稳定的AGS。López-Palau等[35]发现,当饥饿期占曝气时间的33%时,可形成稳定、密实和抵抗力良好的AGS。总之,在长期运行中,饥饿期小于曝气时间的40%时,反应器中可形成沉降性能及稳定性良好的AGS。
EPS作为一种“生物胶”,对AGS的形成和稳定性起着重要贡献[33,36]。在SBR反应器中,EPS主要产生于基质丰富期,同时伴随着COD浓度的下降;在基质缺乏期,颗粒内微生物以EPS为电子供体进行内源呼吸,这种方式是EPS消耗的主要途径[37]。EPS如果过度消耗则好氧颗粒无法形成。但EPS过多,又可能堵塞AGS中用来传递氧气或营养的孔隙,进而使颗粒内部矿化导致稳定性下降[1]。因此,在SBR反应器运行过程中,控制EPS的产生和消耗可以间接控制AGS的形成速度以及运行稳定性。
3 快速好氧颗粒化策略
由AGS形成机理可知,颗粒化速度与反应器内出现紧密颗粒聚集体速度呈正相关。对于以活性污泥为接种物的反应器,微生物聚集体必须通过微生物自凝聚的方式获得,因此提高EPS分泌量以及微生物自凝聚的能力是快速颗粒化的关键,常见措施主要包括向污水中投加絮凝剂、投加钙镁等金属离子、惰性载体以及添加特殊菌种。另外,也可向反应器内直接接种微生物聚集体,如厌氧颗粒污泥、好氧颗粒污泥以及脱水污泥等。
3.1 投加微生物聚集体
HU等[38]以厌氧颗粒污泥为接种污泥,在60 d内实现了颗粒化,出现AGS解体后再颗粒化的现象,但这种方法在提高AGS颗粒化速度方面并不显著。Pijuan等[39]以不同比例的破碎AGS为接种污泥,结果表明,接种50%破碎AGS的反应器18 d内实现污泥颗粒化,接种5%的破碎AGS则需133 d,而未接种AGS的反应器却没有实现好氧颗粒化。Long等[40]首先接种活性污泥,培养过程中逐步缩短沉降时间(25~4 min),待沉降时间缩短至10 min时投加25%(质量比,相比于反应器内MLSS)的成熟AGS,18 d后SBR中实现污泥颗粒化,且未发现AGS解体的现象。He等[41]全部以好氧颗粒污泥为接种污泥与藻类共同培养海藻-细菌颗粒污泥,在第7天就获得了成熟的颗粒污泥。Verawaty等[42]通过荧光标记探索接种部分AGS促进好氧污泥颗粒化的机理,荧光显微(EFM)及SEM技术成功观测到絮状污泥黏附接种AGS表面现象,表明接种AGS充当了新颗粒形成的晶核,从而加速了AGS的形成。因此,接种AGS可以促进颗粒化,在操作条件保证AGS不会解体的情况下,接种比例越高,颗粒化速度越快,如果全部以AGS为接种污泥,7 d即可实现完全颗粒化。这种方法虽然很好,但是大量AGS不易获取。事实上,AGS是自凝聚形成的生物聚集体,并且自凝聚过程也是形成生物聚集体的限制步骤,浓缩污泥虽然不是自凝聚形成,但也是生物聚集体,基于此思路,王良杰等[43]以物理浓缩污泥为接种污泥,20 d可实现污泥颗粒化。
3.2 投加可促进聚集体形成的物质
3.2.1 金属离子
由于细胞表面带负电,可通过投加阳离子对细胞表面进行电中和、压缩双电层以及桥连作用,同时金属离子还能够诱导改变菌群传感系统、EPS分泌以及污泥的疏水性,来共同促进细胞之间的黏附以及聚集。尽管单价阳离子(主要是Na+)也能发挥上述作用,但其作用要弱于多价离子[44],并且过量单价阳离子会杀死微生物[45,46],使污泥解体,因此多价阳离子(主要是Ca2+、Mg2+、Fe3+)更有利于促进颗粒聚集体的快速形成。Sajjad等[47]通过在进水中添加50 mg/L的Mg2+,11 d时在序批式膜生物反应器中观察到AGS,16 d时实现完全颗粒化,发现Mg2+能刺激EPS中蛋白质的过量分泌并易于进入微生物内部。Morais 等[44]发现,ρ(Ca2+)为100,200 mg/L时可促进污泥颗粒化,并且能够增强AGS的稳定性,但当ρ(Ca2+)>300 mg/L时,对颗粒化有不利影响。Li 等[48]以活性污泥为接种污泥,以不同比例的海水(0%、20%、 50%、80%、100%)与模拟废水混合,发现随着海水比例的提高,不仅有利于AGS快速形成,而且增强了AGS的结构。Liu等[49]以含有Ca2+ 25.4 mg/L以及 Fe3+ 1.99 mg/L的养猪场废水在SBR反应器里培养AGS,发现3 d后反应器内基本形成好氧颗粒,但是此时颗粒不稳定且易破碎,没有形成规则的外形,直到18 d后,颗粒量稳步增加、形状更加清晰规则。Kong 等[50]在SBR反应器内投加铁粉,发现好氧颗粒化时间与对照组相比由65 d提高到43 d,主要是由铁粉释放的Fe2+造成的。然而,并非所有的金属离子都能提高微生物的黏附能力,Cu2+、Fe2+、Zn2+等在浓度较低时可提高活性污泥的黏附能力,但却不能提高AGS的黏附能力,AGS比活性污泥对金属离子更敏感[51]。
3.2.2 絮凝剂
Liu等[52]以活性污泥为接种污泥在前8 d,每个周期排水后向反应器内加入PAC,使反应器内PAC浓度保持在500 mg/L,与未添加PAC的反应器相比提前10 d,在第25天就实现了颗粒化。PAC是污水处理过程常用的一种絮凝剂,其促进颗粒形成的主要原因是电中和、压缩双电层、架桥作用以及网捕作用等。同时在PAC、短沉降时间以及高剪切力等选择压作用下,可促使EPS大量分泌,从而使初始颗粒进一步具有良好的物理化学结构以及生物特性,从而实现快速颗粒化。Liang等[53]通过研究9种吡啶降解菌株后发现,聚集能力强的菌株可分泌更多的EPS,而聚集能力差的则分泌的EPS少,进一步说明EPS与AGS的颗粒化速度呈正相关。
3.2.3 工程菌种
AGS是由微生物凝聚而形成的,细胞之间的聚集包括自聚集(同种微生物之间的黏附)和共聚集(不同种微生物之间的黏附),共聚集细胞之间的互惠关系有利于生物膜生长以及生物之间可扩散信号的传递[54]。Jiang 等[54]投加2种工程菌种强化活性污泥的好氧颗粒化及苯酚降解效果,23 d后可实现污泥颗粒化,同时发现PG-02菌株表面的黏附蛋白和PG-08的互补性糖受体可与胞外多糖相互缠绕从而起到凝聚作用。Ivanov等[55]从AGS中分离出絮凝指数>50%的Pseudomonas veronii B菌株培养好氧颗粒,3 d后可观察到粒径>0.5 mm的AGS。因此,接种黏性好的工程菌种能够促进好氧污泥颗粒化,但存在工程菌筛选复杂、成本高以及存在环境安全隐患等问题。
3.3 活性炭等固体载体
促进AGS快速颗粒化的载体主要有粉末活性炭、颗粒活性炭、生物炭等物质。Li等[56]分别将颗粒活性炭和粉末活性炭投加到SBR反应器中,发现颗粒活性炭极大缩短了AGS颗粒化时间,而投加粉末活性炭对AGS颗粒化影响不明显。Zhou等[57]发现,在低有机负荷下粒径为0.2 mm的颗粒活性炭投加到反应器(R2)中,在第31天时可成功实现AGS颗粒化,而未投加颗粒活性炭和投加粒径为0.6 mm颗粒活性炭的反应器均未实现颗粒化。Tao等[58]发现,投加颗粒活性炭对AGS的微生物群落没有明显影响。Zhang等[59]发现,投加生物炭有利于富集降解相关污染物的菌群,并且能够刺激EPS的分泌,从而促进颗粒化。Sun等[60]发现,投加水滑石能够通过刺激EPS的分泌、活性污泥间的桥连和连接作用来加速AGS的颗粒化。Wang等[61]以鸟粪石为载体,发现其可刺激多糖分泌,并对微生物群落产生重要影响,从而加速AGS的颗粒化。总之,投加特定固体物质能够充当AGS形成的核和载体,刺激EPS分泌,从而促进AGS的颗粒化。
4 结论与展望
影响AGS形成的因素众多,针对不同类型的废水水质,同一种方法可能得到的颗粒化效果截然不同,到目前为止尚没有形成统一、高效、可靠的快速培养AGS的模式。因此,要形成统一高效的培养模式,可从以下几方面进一步开展研究:1)好氧颗粒化的评价方法主要是颗粒粒径以及好氧颗粒化率,并未涉及污泥的沉淀性能、污染物去除效果以及污泥中微生物相的观察等,同时对于颗粒污泥粒径的下限,不同文献的定义也不同[29,39,55],因此,建立详细合理的好氧颗粒化的指标体系是一个值得研究的方向。2)好氧颗粒污泥形成的机理尚不明确,利用现代生物分析技术,如高通量测序、荧光原位杂交技术等,加强AGS快速培养过程中微生物相及类型变化的监测,获取颗粒形成过程中的微观原位信息,进而找到好氧颗粒化的机理。3)AGS培养条件较为苛刻且运行参数基本不同,导致各项研究所得结果无可比性。因此,应找到一套适合的AGS培养参数,使后续的研究结果具有可比性及重复性,为好氧颗粒化技术的大规模工程应用提供技术和理论支持。
[1] ROLLEMBERG S L D S, BARROS A R M, FIRMINO P I M, et al. Aerobic granular sludge: cultivation parameters and removal mechanisms[J]. Bioresource Technology, 2018,130: 1-11.
[2] PRONK M, de KREUK M K, de BRUIN B, et al. Full scale performance of the aerobic granular sludge process for sewage treatment[J]. Water Research, 2015, 84: 207-217.
[3] SARMA S J, TAY J H, CHU A. Finding knowledge gaps in aerobic granulation technology[J]. Trends in Biotechnology, 2017, 35(1): 66-78.
[4] RICKARD A H, GILBERT P, HIGH N J, et al. Bacterial coaggregation: an integral process in the development of multi-species biofilms[J]. Trends in Microbiology, 2003, 11(2): 94-100.
[5] NANCHARAIAH Y V, KIRAN KUMAR REDDY G. Aerobic granular sludge technology: mechanisms of granulation and biotechnological applications[J]. Bioresource Technology, 2018, 247: 1128-1143.
[6] LIU Y, TAY J H. State of the art of biogranulation technology for wastewater treatment[J]. Biotechnology Advances, 2004, 22(7): 533-563.
[7] LEE D J, CHEN Y Y, SHOW K Y, et al. Advances in aerobic granule formation and granule stability in the course of storage and reactor operation[J]. Biotechnology Advances, 2010, 28(6): 919-934.
[8] FRANCA R D G, PINHEIRO H M, VAN LOOSDRECHT M C M, et al. Stability of aerobic granules during long-term bioreactor operation[J]. Biotechnology Advances, 2018, 36(1): 228-246.
[9] ZITA A, HERMANSSON M. Determination of bacterial cell surface hydrophobicity of single cells in cultures and in wastewater in situ[J]. FEMS Microbiology Letters, 1997, 152(2): 299-306.
[10] BEUN J J, HENDRIKS A. Aerobic granulation in a sequencing batch reactor[J]. Water Research, 1999, 33(10):2283-2290.
[11] WILÉN B M, GAPES D, KELLER J. Determination of external and internal mass transfer limitation in nitrifying microbial aggregates[J]. Biotechnology and Bioengineering, 2004, 86(4): 445-457.
[12] ADAV S S, LEE D J, LAI J Y. Potential cause of aerobic granular sludge breakdown at high organic loading rates[J]. Applied Microbiology and Biotechnology, 2010, 85(5): 1601-1610.
[13] YANG S F, LI X Y, YU H Q. Formation and characterisation of fungal and bacterial granules under different feeding alkalinity and pH conditions[J]. Process Biochemistry, 2008, 43(1): 8-14.
[14] 张子健,吴伟伟,王建龙. 全自养硝化污泥的颗粒化过程研究[J].环境科学.2010,31(1):140-146.
[15] LIU Y Q, MOY B, KONG Y H, et al. Formation, physical characteristics and microbial community structure of aerobic granules in a pilot-scale sequencing batch reactor for real wastewater treatment[J]. Enzyme and Microbial Technology, 2010, 46(6): 520-525.
[16] HAMZA R A, IORHEMEN O T, ZAGHLOUL M S, et al. Rapid formation and characterization of aerobic granules in pilot-scale sequential batch reactor for high-strength organic wastewater treatment[J]. Journal of Water Process Engineering, 2018, 22: 27-33.
[17] CHEN Y, JIANG W J, LIANG D T, et al. Aerobic granulation under the combined hydraulic and loading selection pressures[J]. Bioresource Technology, 2008, 99(16): 7444-7449.
[18] ZHANG Z M, QIU J X, XIANG R H, et al. Organic loading rate (OLR) regulation for enhancement of aerobic sludge granulation: Role of key microorganism and their function[J]. Science of the Total Environment, 2019, 653: 630-637.
[19] LIU Y Q, TAY J H. Fast formation of aerobic granules by combining strong hydraulic selection pressure with overstressed organic loading rate[J]. Water Research, 2015, 80: 256-266.
[20] FRANCA R D G, ORTIGUEIRA J, PINHEIRO H M, et al. Effect of SBR feeding strategy and feed composition on the stability of aerobic granular sludge in the treatment of a simulated textile wastewater[J]. Water Science and Technology, 2017, 76(5): 1188-1195.
[21] MOY B Y P, TAY J H, TOH S K, et al. High organic loading influences the physical characteristics of aerobic sludge granules[J]. Letters in Applied Microbiology, 2002, 34(6): 407-412.
[22] WOSMAN A, LU Y, SUN S, et al. Effect of operational strategies on activated sludge’s acclimation to phenol, subsequent aerobic granulation, and accumulation of polyhydoxyalkanoates[J]. Journal of Hazardous Materials, 2016, 317: 221-228.
[23] HE Q L, ZHANG W, ZHANG S L, et al. Enanced nitrogen removal in an aerobic granular sequencing batch reactor performing simultaneous nitrification, endogenous denitrification and phosphorus removal with low superficial gas velocity[J]. Chemical Engineering Journal, 2017, 326: 1223-1231.
[24] LI A J, LI X Y, YU H Q. Effect of the food-to-microorganism (F/M) ratio on the formation and size of aerobic sludge granules[J]. Process Biochemistry, 2011, 46(12): 2269-2276.
[25] ZHOU J H, ZHANG Z M, ZHAO H, et al. Optimizing granules size distribution for aerobic granular sludge stability: effect of a novel funnel-shaped internals on hydraulic shear stress[J]. Bioresource Technology, 2016, 216: 562-570.
[26] DEVLIN T R, DI BIASE A, KOWALSKI M, et al. Granulation of activated sludge under low hydrodynamic shear and different wastewater characteristics[J]. Bioresource Technology, 2017, 224: 229-235.
[27] TAY J H, LIU Q S, LIU Y. The effects of shear force on the formation, structure and metabolism of aerobic granules[J]. Applied Microbiology and Biotechnology, 2001, 57(1/2): 227-233.
[28] CHEN Y, JIANG W J, LIANG D T, et al. Structure and stability of aerobic granules cultivated under different shear force in sequencing batch reactors[J]. Applied Microbiology and Biotechnology, 2007, 76(5): 1199-1208.
[29] LONG B, YANG C Z, PU W H, et al. Rapid cultivation of aerobic granule for the treatment of solvent recovery raffinate in a bench scale sequencing batch reactor[J]. Separation and Purification Technology, 2016, 160: 1-10.
[30] LIU Y, TAY J. The essential role of hydrodynamic shear force in the formation of biofilm and granula sluge[J]. Water Research, 2002, 36(7): 1653-1665.
[31] QIN L, TAY J H, LIU Y. Selection pressure is a driving force of aerobic granulation in sequencing batch reactors[J]. Process Biochemistry, 2004, 39(5): 579-584.
[32] LIU Y Q, TAY J H. Influence of starvation time on formation and stability of aerobic granules in sequencing batch reactors[J]. Bioresource Technology, 2008, 99(5): 980-985.
[33] WANG Z W, LIU Y, TAY J H. Distribution of EPS and cell surface hydrophobicity in aerobic granules[J]. Applied Microbiology and Biotechnology, 2005, 69(4): 469-473.
[34] WANG X F, OEHMEN A, FREITAS E B, et al. The link of feast-phase dissolved oxygen (DO) with substrate competition and microbial selection in PHA production[J]. Water Research, 2017, 112: 269-278.
[35] L PEZ-PALAU S, PINTO A, BASSET N, et al. ORP slope and feast-famine strategy as the basis of the control of a granular sequencing batch reactor treating winery wastewater[J]. Biochemical Engineering Journal, 2012, 68: 190-198.
PEZ-PALAU S, PINTO A, BASSET N, et al. ORP slope and feast-famine strategy as the basis of the control of a granular sequencing batch reactor treating winery wastewater[J]. Biochemical Engineering Journal, 2012, 68: 190-198.
[36] ADAV S S, LEE D J, SHOW K Y, et al. Aerobic granular sludge: recent advances[J]. Biotechnology Advances, 2008, 26(5): 411-423.
[37] CORSINO S F, CAMPO R, DI BELLA G, et al. Cultivation of granular sludge with hypersaline oily wastewater[J]. International Biodeterioration and Biodegradation, 2015, 105: 192-202.
[38] HU L L, WANG J L, WEN X H, et al. The formation and characteristics of aerobic granules in sequencing batch reactor (SBR) by seeding anaerobic granules[J]. Process Biochemistry, 2005, 40(1): 5-11.
[39] PIJUAN M, WERNER U, YUAN Z G. Reducing the startup time of aerobic granular sludge reactors through seeding floccular sludge with crushed aerobic granules[J]. Water Research, 2011, 45(16): 5075-5083.
[40] LONG B, YANG C Z, PU W H, et al. Rapid cultivation of aerobic granular sludge in a pilot scale sequencing batch reactor[J]. Bioresource Technology, 2014, 166: 57-63.
[41] HE Q L, CHEN L, ZHANG S J, et al. Natural sunlight induced rapid formation of water-born algal-bacterial granules in an aerobic bacterial granular photo-sequencing batch reactor[J]. Journal of Hazardous Materials, 2018, 359: 222-230.
[42] VERAWATY M, PIJUAN M, YUAN Z, et al. Determining the mechanisms for aerobic granulation from mixed seed of floccular and crushed granules in activated sludge wastewater treatment[J]. Water Research, 2012, 46(3): 761-771.
[43] 王良杰,湛含辉,孙璨. 以脱水污泥为接种污泥促进好氧污泥颗粒化[J].中国环境科学 2016,36(11):3405-3411.
[44] MORAIS I L H, SILVA C M, ZANUNCIO J C, et al. Structural stabilization of granular sludge by addition of calcium ions into aerobic bioreactors[J]. Bioresources, 2018, 13(1): 176-191.
[45] BASSIN J P, PRONK M, MUYZER G, et al. Effect of elevated salt concentrations on the aerobic granular sludge process: linking microbial activity with microbial community structure[J]. Applied and Environmental Microbiology, 2011, 77(22): 7942-7953.
[46] TAHERI E, KHIADANI HAJIAN M H, AMIN M M, et al. Treatment of saline wastewater by a sequencing batch reactor with emphasis on aerobic granule formation[J]. Bioresource Technology, 2012, 111: 21-26.
[47] SAJJAD M, KIM K S. Studies on the interactions of Ca2+ and Mg2+ with EPS and their role in determining the physicochemical characteristics of granular sludges in SBR system[J]. Process Biochemistry, 2015, 50(6): 966-972.
[48] LI X L, LUO J H, GUO G, et al. Seawater-based wastewater accelerates development of aerobic granular sludge: a laboratory proof-of-concept[J]. Water Research, 2017, 115: 210-219.
[49] LIU J, LI J, WANG X D, et al. Rapid aerobic granulation in an SBR treating piggery wastewater by seeding sludge from a municipal WWTP[J]. Journal of Environmental Sciences, 2017, 51: 332-341.
[50] KONG Q, NGO H H, SHU L, et al. Enhancement of aerobic granulation by zero-valent iron in sequencing batch airlift reactor[J]. Journal of Hazardous Materials, 2014, 279: 511-517.
[51] HAO W, LI Y C, LV J P, et al. The biological effect of metal ions on the granulation of aerobic granular activated sludge[J]. Journal of Environmental Sciences (China), 2016, 44: 252-259.
[52] LIU Z, LIU Y J, ZHANG A N, et al. Study on the process of aerobic granule sludge rapid formation by using the poly aluminum chloride (PAC)[J]. Chemical Engineering Journal, 2014, 250: 319-325.
[53] LIANG J, LI W, ZHANG H L, et al. Coaggregation mechanism of pyridine-degrading strains for the acceleration of the aerobic granulation process[J]. Chemical Engineering Journal, 2018, 338: 176-183.
[54] JIANG H L, TAY J H, MASZENAN A M, et al. Enhanced phenol biodegradation and aerobic granulation by two coaggregating bacterial strains[J]. Environmental Science and Technology, 2006, 40(19): 6137-6142.
[55] IVANOV V, WANG X H, STABNIKOVA O. Starter culture of Pseudomonas veronii strain B for aerobic granulation[J]. World Journal of Microbiology and Biotechnology, 2008, 24(4): 533-539.
[56] LI A J, LI X Y, YU H Q, et al. Granular activated carbon for aerobic sludge granulation in a bioreactor with a low-strength wastewater influent[J]. Separation and Purification Technology, 2011, 80(2): 276-283.
[57] ZHOU J H, ZHAO H, HU M, et al. Granular activated carbon as nucleating agent for aerobic sludge granulation: effect of GAC size on velocity field differences (GAC versus flocs) and aggregation behavior[J]. Bioresource Technology, 2015, 198: 358-363.
[58] TAO J, QIN L, LIU X Y, et al. Effect of granular activated carbon on the aerobic granulation of sludge and its mechanism[J]. Bioresource Technology, 2017, 236: 60-67.
[59] ZHANG D J, LI W, HOU C, et al. Aerobic granulation accelerated by biochar for the treatment of refractory wastewater[J]. Chemical Engineering Journal, 2017, 314: 88-97.
[60] SUN H Y, CHEN S P, LIU J Y, et al. Role of layered double hydroxide in improving the stability of aerobic granular sludge[J]. Clean-Soil Air Water, 2017, 45(4): 2-8.
[61] WANG G W, WANG D, XU X C, et al. Partial nitrifying granule stimulated by struvite carrier in treating pharmaceutical wastewater[J]. Applied Microbiology and Biotechnology, 2013, 97(19): 8757-8765.