石油类污染是土壤中较为常见的污染类型,其主要组分包括C15—C36的烷烃、烯烃、苯系物、多环芳烃、脂类等,其中被列入美国规定的优先控制污染物的多达30余种[1]。土壤中的石油类污染物可随着地表径流进入地表水体,通过降雨淋溶、渗透作用进入深层土壤和地下水,并通过食物链在人体内累积,危害人类健康。
化学氧化技术具有氧化效率高、处理时间短、适用范围广等优点,广泛应用于有机污染场地修复,其中Fenton(H2O2+Fe2+)和活化过硫酸钠(Na2S2O8)是最常用的氧化剂。当H2O2和Fe2+在酸性条件下共存时,H2O2会发生显著分解产生羟基自由基 (·OH),其氧化还原电位为2.8 V[2],传统均相Fenton工艺的最佳pH为2.8[3],而天然地下水环境为近中性,这容易造成Fe3+沉淀。研究发现,柠檬酸可通过络合与铁离子形成高密度配合物,保持中性土壤环境中铁的催化特性[4]。过硫酸盐是一类新型氧化剂,其经活化后分解产生高氧化性和反应性的![]() 氧化还原电位为2.6 V[5]。此外,在强碱环境中
氧化还原电位为2.6 V[5]。此外,在强碱环境中![]() 会迅速与OH-反应生成·OH[6],从而引发一系列的自由基链反应,因此碱活化过硫酸盐技术是当前土壤修复技术研究的热点。
会迅速与OH-反应生成·OH[6],从而引发一系列的自由基链反应,因此碱活化过硫酸盐技术是当前土壤修复技术研究的热点。
Fe2++H2O2→Fe3++·OH+OH-(1)
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
总反应:![]()
![]() (5)
(5)
![]() (6)
(6)
目前,TPH污染土壤的化学氧化修复研究主要以降解效果、药剂浓度影响研究为主[7-11],较少从工程实践角度对包括加药方式、药剂混合方式、土壤粒径等影响土壤修复效率的工艺参数进行研究,实际污染土壤化学氧化修复中存在修复见效慢、药剂利用率低、成本高等问题。本文以某轴承厂旧址的TPH污染土壤为研究对象,对比了不同氧化体系对TPH污染土壤的修复效果,研究了药剂投加量、混合方式、加药方式、土壤粒径等因素对TPH降解的影响,探究了不同氧化体系的主要机理,旨在为TPH污染土壤修复工程提供参考。
供试土壤取自上海某退役轴承厂用地,场地调查结果表明,该场地主要存在TPH污染,部分区域As、Hg少量超标。供试土壤采样深度为原场地地表下1~1.5 m,土壤密度为1.94 g/cm3,含水率为33.3%。土壤采样后经除杂、初步破碎、混匀后室内自然避光风干,实验前土壤均经进一步研磨破碎、混匀处理后过筛备用。经分析土壤样品质地为粉质黏土,TPH平均含量为6.55 g/kg,主要为碳链长度为C6—C16及C17—C36的TPH,As、Hg含量低于GB 36600—2018《土壤环境质量 建设用地土壤污染风险筛选值》第一类用地风险筛选值,平均pH值为8.5。
主要仪器:红外测油仪(OCMA-350型,日本);台式低速离心机(TD5M,上海卢湘仪)、电子分析天平(AL204,瑞士Mettler-Toledo)、pH计(DELTA320,瑞士 Mettler-Toledo)、超纯水仪(Classic DI,英国 ELGA 公司)、电子顺磁共振仪(EMX-8/2.7C,德国BRUKER)。
试剂:30%H2O2、Na2S2O8、NaOH、FeSO4·7H2O、柠檬酸等均为分析纯,试剂均购于上海晶纯实业有限公司。
实验主要考察氧化体系类型、药剂投加量、加药方式、药剂混合方式(振荡、静置)及土壤粒径等因素对TPH降解的影响,共设置22组实验,分为组1—22,实验条件见表1,实验土样10 g,泥水质量比=1/1。混合方式分为静置及振荡,在加药总量恒定的条件下,加药方式分为1次(0 min)、2次(0,180 min)及3次(0,120,240 min)等量加药。
土壤有机物(SOM)含量采用重量法测定。以CCl4为萃取剂,采用非分散红外石油仪测定萃取液中TPH含量。非分散红外测油仪用纯CCl4调零,并用标定液标定满量程。
实验研究了H2O2、Fenton(Fe2++H2O2)、类Fenton (Fe2+-柠檬酸/H2O2)及碱活化过硫酸盐4种氧化体系对土壤中TPH的降解效果(图1),结果表明,Fenton、类Fenton及碱活化过硫酸盐对TPH都有显著降解效果,其中类Fenton效果最佳。这是因为柠檬酸的加入与催化剂Fe2+形成络合物,提高了体系中溶解性Fe2+的浓度。陈玉等[12]也在研究中指出,柠檬酸与 Fe2+反应生成的络合物具有较高的光化学活性,可以吸收可见光产生·OH,进一步改善污染物去除效果。Fenton体系中,TPH降解速率在反应30 min后迅速减缓,这是由于Fe2+被氧化为Fe3+,催化活性降低。碱活化过硫酸盐体系中,反应6 h后TPH的去除率达到58.5%。根据实验参数,进一步通过反应式(1)、(5)和(6)推算,活化过硫酸盐及类Fenton体系中·OH的理论浓度分别为0.05,0.3 mol/L,而前者对TPH的降解效果达到后者的67%(=58.5/86.2),这表明活化过硫酸盐体系中除了·OH外还有其他降解途径。朱杰等[13]指出,碱热活化过硫酸盐氧化氯苯反应中存在![]() 等自由基的作用。
等自由基的作用。
对实验数据按准一级反应动力学方程[式(7)]拟合,结果见表2。在类Fenton及活化过硫酸盐体系中,TPH降解趋势均符合准一级反应动力学,且前者反应动力学常数更大,表明降解速率更快。在Fenton体系中,TPH的降解不符合准一级反应动力学,这进一步证明柠檬酸可以改善Fenton体系对TPH的降解性能。
表1 实验参数
Table 1 Experimental parameters

组别考察因子氧化体系实验条件反应方式粒径1氧化体系H2O2n(H2O2) (30%)=1 mol/L研磨,振荡2 mm2Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L研磨,振荡2 mm3类Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,振荡2 mm4碱活化过硫酸盐n(Na2S2O3)=0.1 mol/L,n(NaOH)=1 mol/L研磨,振荡2 mm5反应方式Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L研磨,振荡2 mm6Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L研磨,静置2 mm7类Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,振荡2 mm8类Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,静置2 mm9碱活化过硫酸盐n(Na2S2O3)=0.1 mol/L,n(NaOH)=1 mol/L研磨,振荡2 mm10碱活化过硫酸盐n(Na2S2O3)=0.1 mol/L,n(NaOH)=1 mol/L研磨,静置2 mm11粒径类Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,振荡2 mm12类Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,振荡5 mm13类Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,振荡10 mm14碱活化过硫酸盐n(Na2S2O3)=0.1 mol/L,n(NaOH)=1 mol/L研磨,振荡2 mm15碱活化过硫酸盐n(Na2S2O3)=0.1 mol/L,n(NaOH)=1 mol/L研磨,振荡5 mm16碱活化过硫酸盐n(Na2S2O3)=0.1 mol/L,n(NaOH)=1 mol/L研磨,振荡10 mm17投加量类Fentonn(H2O2) (30%)=0.5 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.1 mol/L研磨,振荡2 mm18类Fentonn(H2O2) (30%)=0.5 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,振荡2 mm19类Fentonn(H2O2) (30%)=1 mol/L,n(Fe2+)=0.1 mol/L,n(柠檬酸)=0.05 mol/L研磨,振荡2 mm20碱活化过硫酸盐n(Na2S2O3)=0.05 mol/L,n(NaOH)=1 mol/L研磨,振荡2 mm21碱活化过硫酸盐n(Na2S2O3)=0.1 mol/L,n(NaOH)=1 mol/L研磨,振荡2 mm22碱活化过硫酸盐n(Na2S2O3)=0.2 mol/L,n(NaOH)=1 mol/L研磨,振荡2 mm

![]() —H2O2;
—H2O2; ![]() —Fenton;
—Fenton; ![]() —类Fenton;
—类Fenton; ![]() —碱活化过硫酸盐。
—碱活化过硫酸盐。
图1 不同氧化体系振荡方式下TPH降解效果
Figure 1 TPH degradation performance under vibrating mode in different systems
![]() (7)
(7)
式中:C0, TPH为TPH在零时刻的浓度,mg/L;Ct, TPH为TPH在t时刻的浓度,mg/L;k为准一级反应动力学常数,min-1。
表2 不同体系中TPH降解动力学参数
Table 2 Kinetic values of TPH degradation in different systems
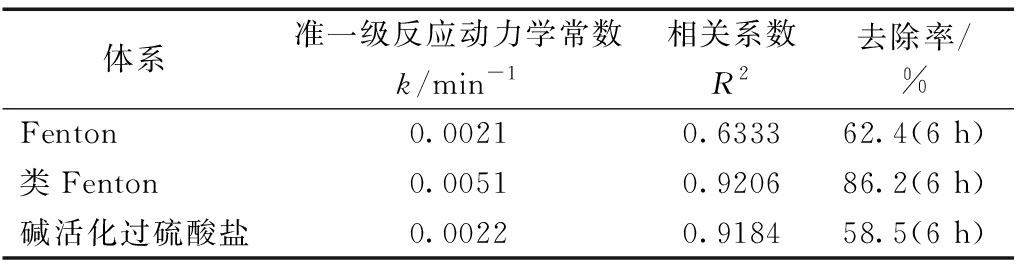
体系准一级反应动力学常数k/min-1相关系数R2去除率/%Fenton0.00210.633362.4(6 h)类Fenton0.00510.920686.2(6 h)碱活化过硫酸盐0.00220.918458.5(6 h)
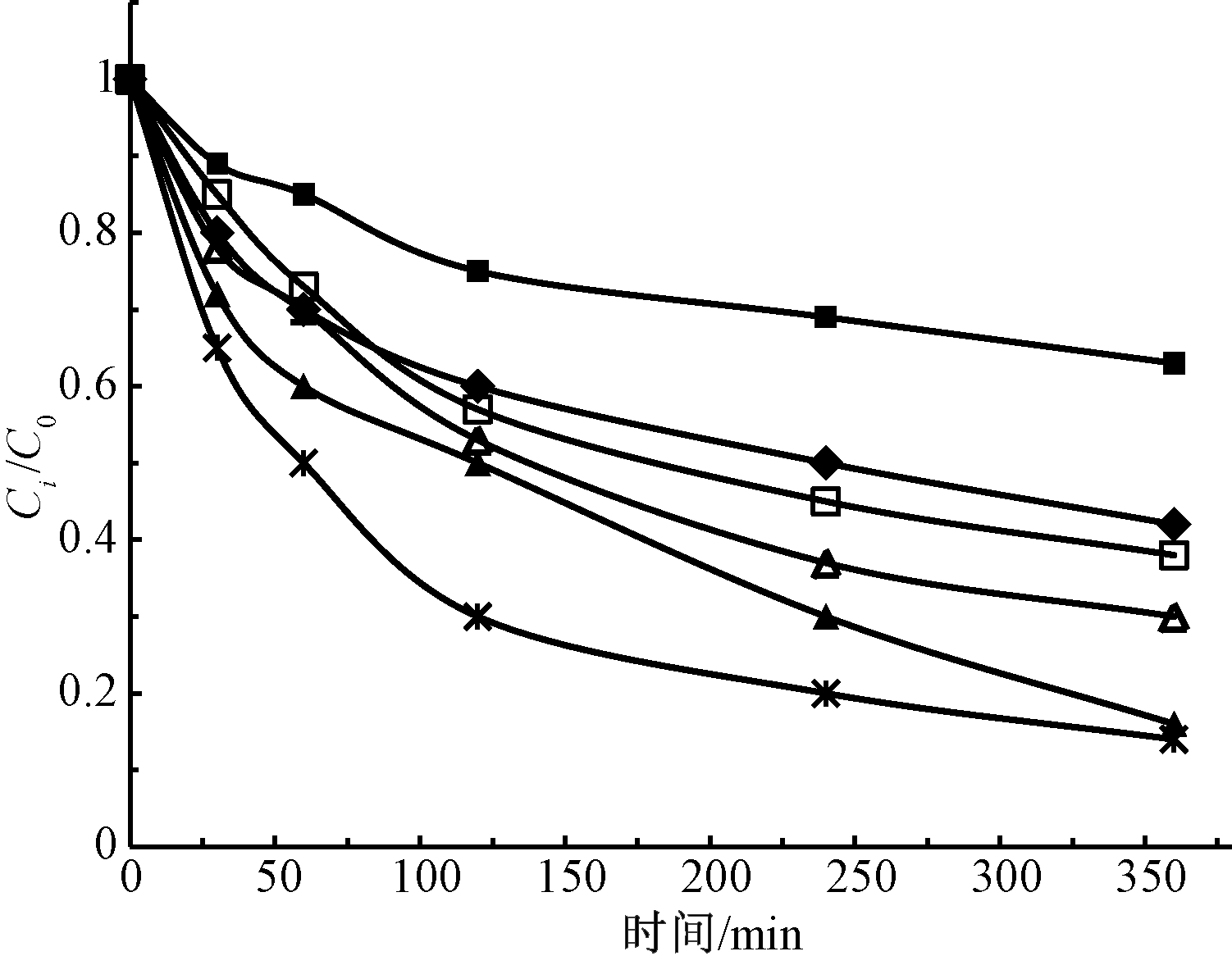
通常,氧化剂、络合剂的投加量是影响修复效果的重要因素,其具体影响如图2所示。在类Fenton体系中,提高H2O2及柠檬酸的浓度均有利于TPH的降解,H2O2浓度提高有助于更多自由基的产生,柠檬酸浓度提高可以更好地稳定Fe2+,均有力地促进了TPH降解反应的进行,这与杨玲引等[14]的研究结果类似,即在一定范围内TPH降解效果随着H2O2、柠檬酸浓度的升高而升高。在碱活化过硫酸盐体系中,过硫酸盐的浓度越高,TPH的降解效果越好。吴昊等[15]也得出,增加过硫酸盐(Fe2+活化)的投加量可显著提高TPH的去除率。
![]() —组17;
—组17; ![]() —组18;
—组18; ![]() —组19;
—组19; ![]() —组20;
—组20; ![]() —组21;
—组21; ![]() —组22。
—组22。
图2 药剂浓度对TPH降解效果的影响
Figure 2 Effect of chemical concentration on TPH degradation performance
对实验数据按准一级反应动力学方程拟合,结果见表3。可知:类Fenton及碱活化过硫酸盐体系中TPH降解准一级动力学速率常数最高分别为 0.0051,0.0047 min-1,对应·OH的理论浓度分别为0.3,0.1 mol/L。这进一步表明碱活化过硫酸盐体系中除了·OH外,还有![]() 等自由基的作用,与Liang[15]在碱性过硫酸盐氧化体系中检测到的活性自由基组成相符。
等自由基的作用,与Liang[15]在碱性过硫酸盐氧化体系中检测到的活性自由基组成相符。
表3 不同参数下TPH降解动力学参数
Table 3 Kinetic values of TPH degradation under different conditions
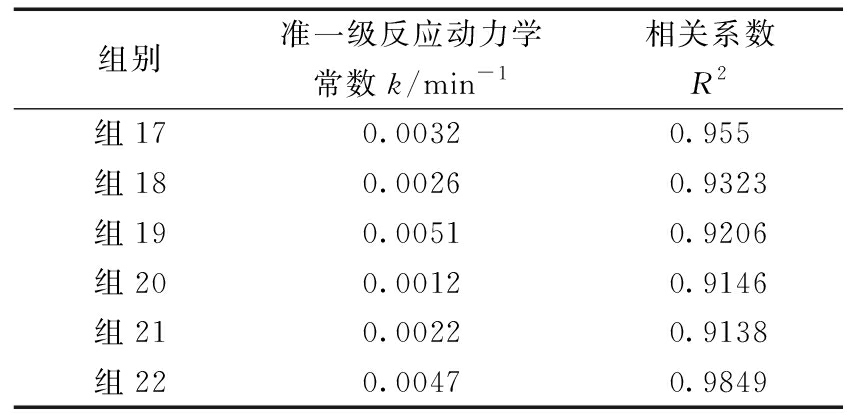
组别准一级反应动力学常数k/min-1相关系数R2组170.00320.955组180.00260.9323组190.00510.9206组200.00120.9146组210.00220.9138组220.00470.9849
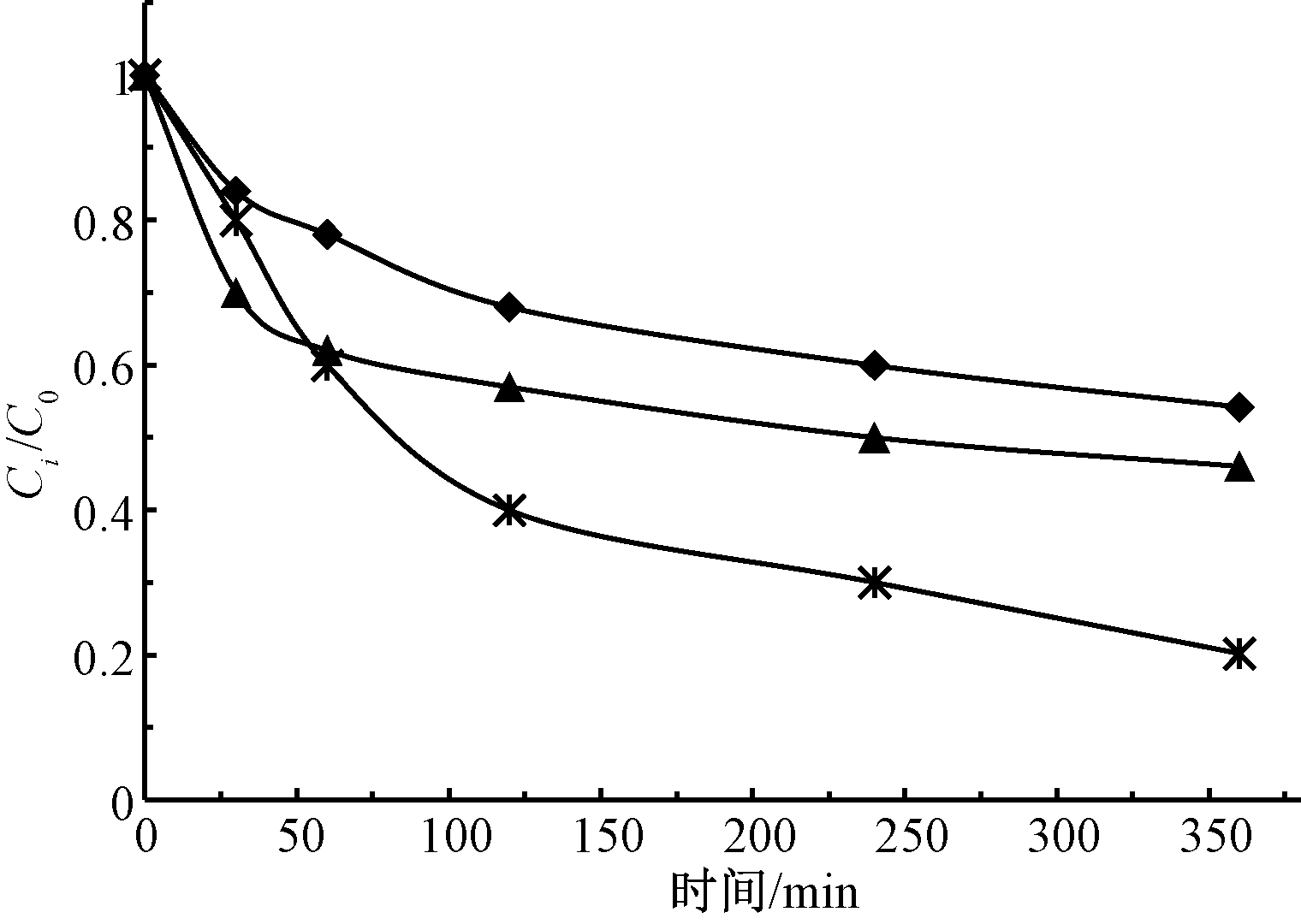
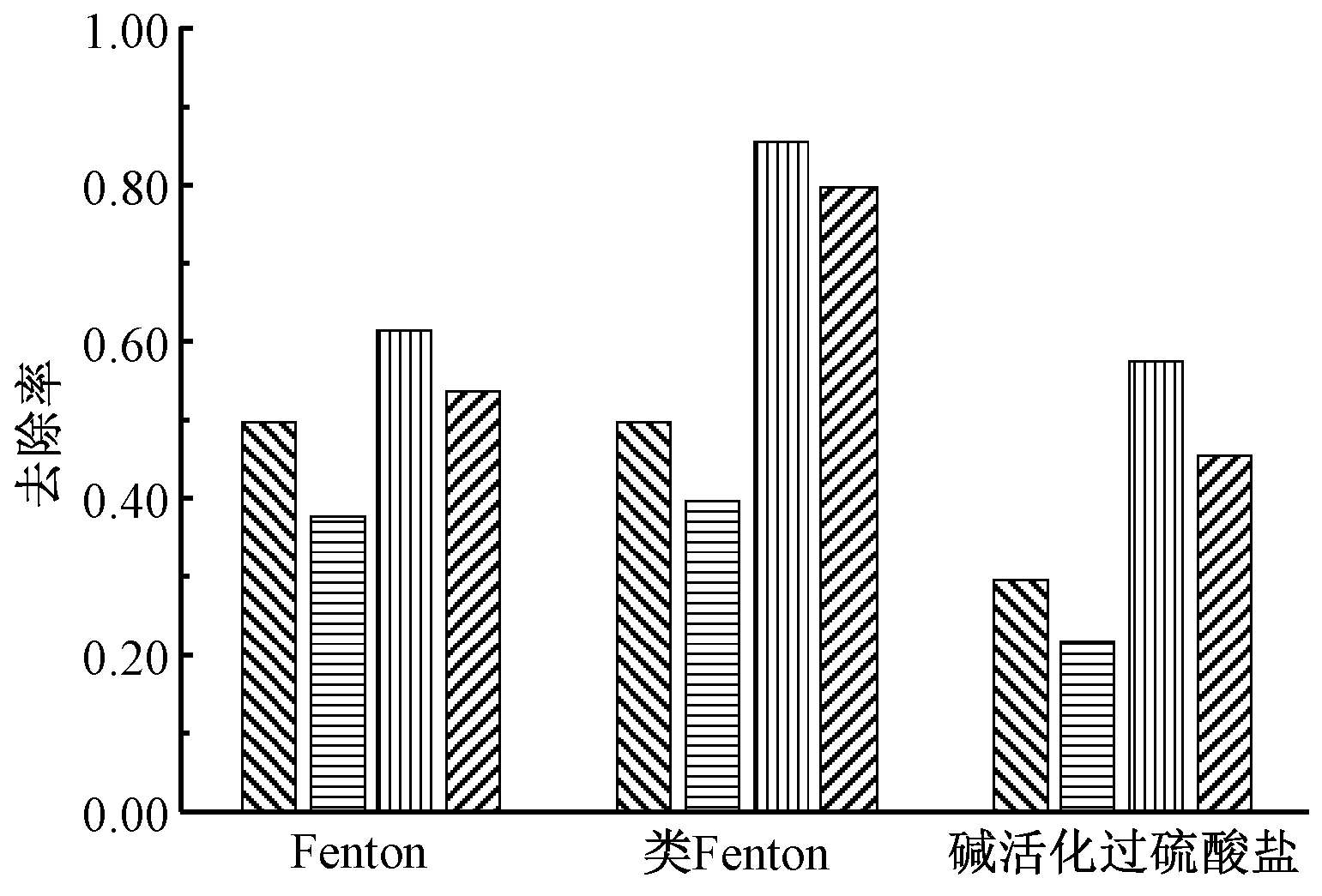
反应方式是影响修复效果的重要因素,实验研究了药剂混合方式和加药方式对TPH降解效果的影响。混合方式分为静置及振荡,在加药总量恒定的条件下,加药方式分为1次(0 min)、2次(0,180 min)及3次(0,120,240 min)等量加药。静置方式下TPH的降解效果见图3,TPH降解效果顺序为类Fenton>Fenton>碱活化过硫酸盐。图4对比了振荡及静置方式下不同反应时间的TPH去除率。可知:振荡方式下TPH的去除率较静置方式提高了8%~12%。对比不同时间2种混合方式下TPH降解率差异可以发现,反应360 min后与反应60 min时基本一致,静置对TPH降解的不利影响主要集中在反应初期60 min,反应后期由于TPH及氧化剂浓度的降低,振荡或静置对降解率影响较小。因此,控制反应初期的药剂混合效果是保证TPH降解效果的关键。
![]() —Fenton;
—Fenton; ![]() —类Fenton;
—类Fenton; ![]() —碱活化过硫酸盐。
—碱活化过硫酸盐。
图3 不同体系静置方式下TPH的降解效果
Figure 3 TPH degradation performance under standing mode in different systems
![]() 振荡60 min;
振荡60 min; ![]() 静置60 min;
静置60 min; ![]() 振荡360 min;
振荡360 min; ![]() 静置360 min。
静置360 min。
图4 混合方式对TPH降解的影响
Figure 4 Effect of different mixing modes on TPH degradation performance
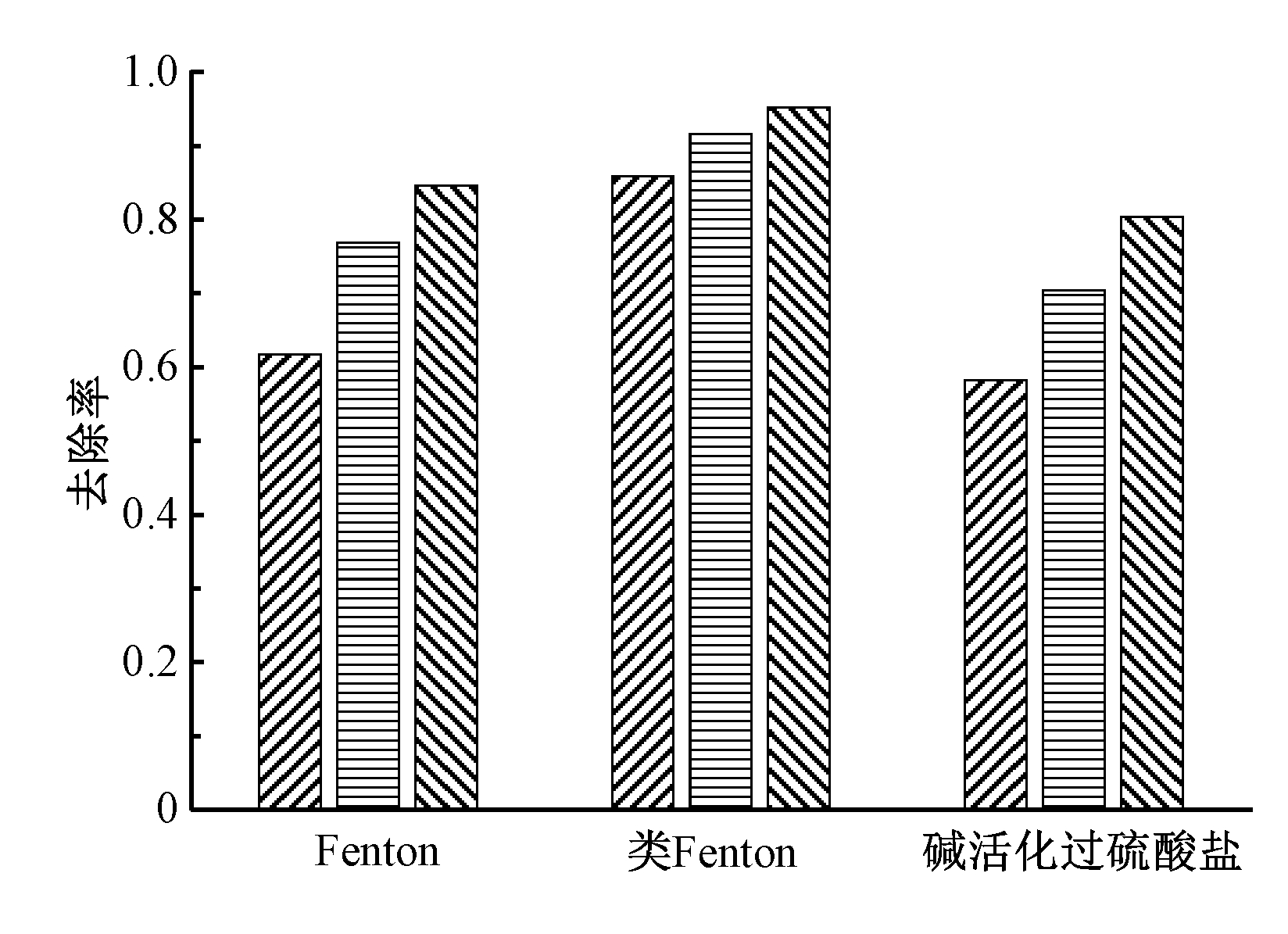
图5为H2O2浓度1 mol/L、Fe2+浓度0.1 mol/L、柠檬酸浓度0.05 mol/L以及过硫酸盐浓度0.1 mol/L、NaOH浓度1 mol/L 2种条件下,分次等量投加氧化剂时的TPH降解效果。可知:当氧化剂分次投加后,污染土壤中TPH的降解率均有所提高,如碱活化过硫酸盐体系中,TPH降解率从1次投加时的58.5%提高到3次投加时的80.6%,与过硫酸盐浓度为0.2 mol/L、NaOH浓度为1 mol/L时的TPH降解率(83.9%)相当,表明分批次投加过硫酸盐可显著节省过硫酸盐用量。这主要与2个体系中复杂的链反应有关,例如H2O2除了与Fe2+发生反应外,也能与·OH发生反应(式(8)),其中k为反应速率常数,下同),并且·OH也能互相发生反应而淬灭(式(9)),因此一次性投加过量的H2O2会消耗·OH,对TPH的降解不利。此外,H2O2可以氧化Fe2+为Fe3+(式(10)),而Fe3+的催化活性较Fe2+弱,不利于催化反应的进行。在碱活化过硫酸盐体系中,过量的过硫酸钠会消耗![]() 式(11)),产生的
式(11)),产生的![]() 也会与·OH反应,从而不利于TPH的降解。分次投加氧化剂降低了H2O2及过硫酸盐的初始浓度,减少了对·OH及
也会与·OH反应,从而不利于TPH的降解。分次投加氧化剂降低了H2O2及过硫酸盐的初始浓度,减少了对·OH及![]() 的消耗,提高了氧化剂的利用效率。辛磊[16]采用逐级Fenton氧化降解石油污染的研究也证明了这一现象。因此,在实际应用中可通过分次投加氧化剂的方式节省氧化药剂的用量。
的消耗,提高了氧化剂的利用效率。辛磊[16]采用逐级Fenton氧化降解石油污染的研究也证明了这一现象。因此,在实际应用中可通过分次投加氧化剂的方式节省氧化药剂的用量。
k=2.7×107 L/(mol·s) (8)
2·OH→H2O2
k=5.2×109 L/(mol·s) (9)
·OH+Fe2+→Fe3++HO-
k=3.0×108 L/(mol·s) (10)
k=6.1×105 L/(mol·s) (11)
![]() (12)
(12)
![]() 1次;
1次; ![]() 2次;
2次; ![]() 3次。
3次。
图5 分次投加氧化剂对TPH降解效果的影响
Figure 5 Effect of adding oxidant in batches on TPH degradation performance
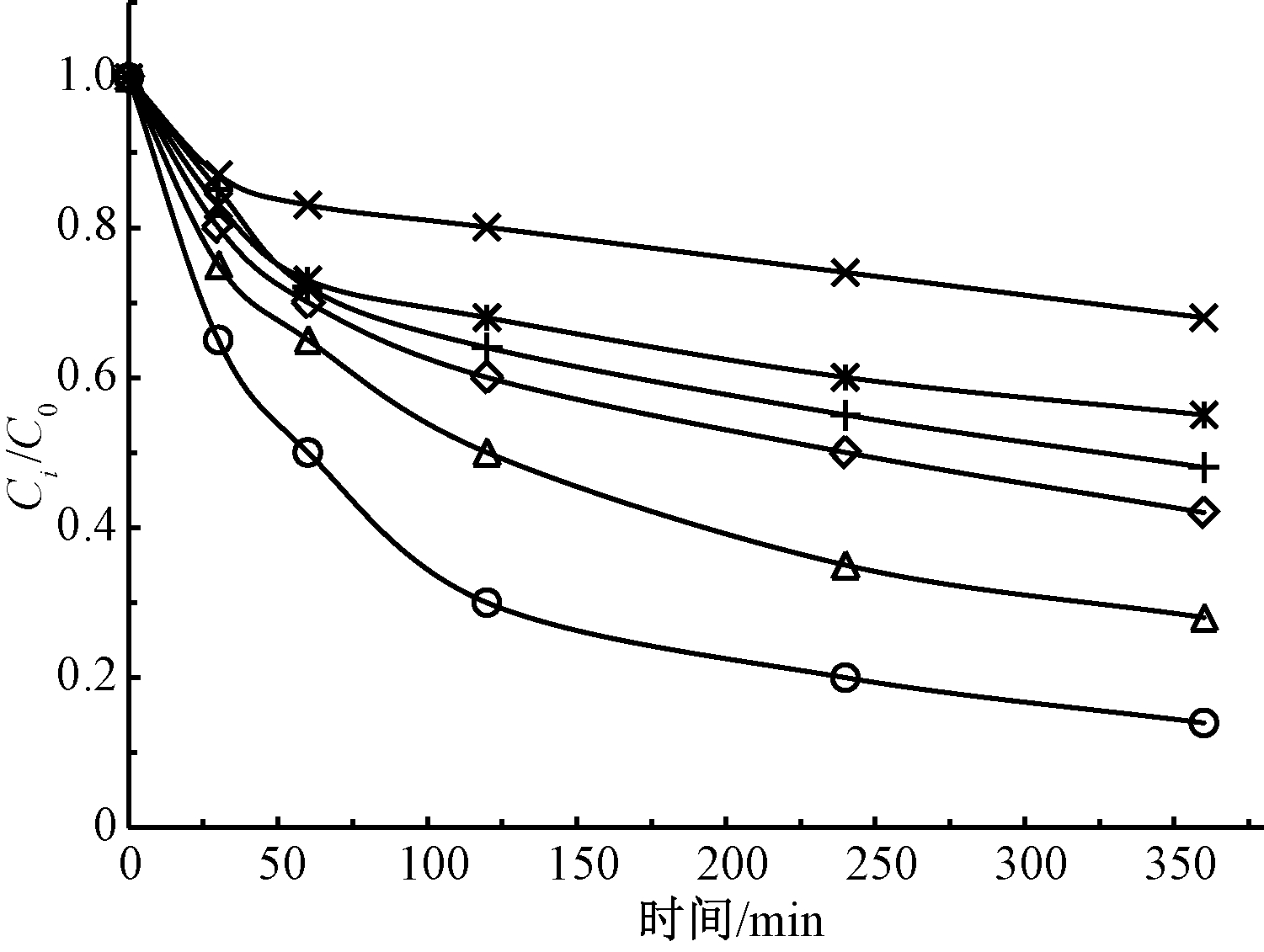
图6为土壤粒径对TPH降解的影响。可知:土壤粒径越小对TPH的降解越有利,例如在类Fenton体系中,2,5,10 mm土壤粒径下反应6 h后TPH的去除率分别为86.2%、72%和52%。而在碱活化过硫酸盐中,2,5,10 mm土壤粒径下TPH的去除率分别为58%、45%和32%。这是因为粒径大小影响了氧化剂的传质效率,一方面较大粒径的土壤由于土壤结构未破坏,内部结构较为紧实,且颗粒比表面积大,不利于氧化剂的传质。因此,在实际土壤修复中,控制土壤粒径是关键措施。
![]() —组11;
—组11; ![]() —组12;
—组12; ![]() —组13;
—组13; ![]() —组14;
—组14; ![]() —组15;
—组15; ![]() —组16。
—组16。
图6 土壤粒径对TPH降解效果的影响
Figure 6 Effect of soil particle size on TPH degradation performance
为了阐明类Fenton及碱活化过硫酸盐体系降解TPH的机理,实验在反应30 min时采集样品,通过EPR检测体系中的主体自由基组成,结果如图7所示。可知:类Fenton体系中有明显的·OH自由基特征峰存在,因此·OH自由基氧化是TPH降解主要机理。在碱活化过硫酸盐体系中,可能是由于![]() 等其他自由基的干扰,·OH自由基的特征峰强度较类Fenton体系弱,表明该体系中可能有其他自由基存在。Fang等[18]采用电子顺磁共振技术(EPR)检测了室温条件下过硫酸盐转化多氯联苯过程中产生的自由基,碱性(pH=13)条件下检测到·OH。Furman等[19]研究了碱活过硫酸盐机理,认为过硫酸盐首先经过碱催化水解产生氢过氧化物阴离子
等其他自由基的干扰,·OH自由基的特征峰强度较类Fenton体系弱,表明该体系中可能有其他自由基存在。Fang等[18]采用电子顺磁共振技术(EPR)检测了室温条件下过硫酸盐转化多氯联苯过程中产生的自由基,碱性(pH=13)条件下检测到·OH。Furman等[19]研究了碱活过硫酸盐机理,认为过硫酸盐首先经过碱催化水解产生氢过氧化物阴离子![]() 及
及![]() 再还原过硫酸盐产生
再还原过硫酸盐产生![]() 同时
同时![]() 被氧化生成还原性超氧根自由基
被氧化生成还原性超氧根自由基![]() 因此推测碱活化过硫酸盐体系中TPH的降解是
因此推测碱活化过硫酸盐体系中TPH的降解是![]() 及
及![]() 等自由基共同作用的结果。
等自由基共同作用的结果。

……类Fenton; ——碱活化过硫酸盐。
图7 电子顺磁共振自由基谱图
Figure 7 EPR spectra of free radical in different systems
以实际TPH污染土壤为对象,研究了H2O2、Fenton、类Fenton及碱活化过硫酸盐4个体系对TPH污染土壤的修复效果,具体结论如下:
1)Fenton、类Fenton及碱活化过硫酸盐均对TPH污染土壤修复有较好效果,类Fenton体系效果最佳,柠檬酸的加入明显改善了Fenton体系的催化性能。TPH在类Fenton及碱活化过硫酸盐体系中的降解过程符合准一级反应动力学。
2)通过振荡等方式促进氧化剂与污染土壤的混合,可明显提高TPH的降解效果,主要体现在反应初期60 min,因此在实际应用中控制反应初期的药剂混合效果是关键。
3)分次投加氧化剂可提高TPH的降解效果,节省氧化剂用量。土壤粒径越小对TPH的降解越有利。
4)类Fenton体系中·OH氧化是主要降解机理,碱活化过硫酸盐体系中有![]() 及
及![]() 等的共同作用,因此氧化剂利用率较高。
等的共同作用,因此氧化剂利用率较高。
5)类Fenton及碱活化过硫酸盐氧化对TPH污染土壤修复有良好的应用效果,实际应用中应通过加药量、加药方式、混合、土壤粒径等工艺参数的控制,提高修复效果,降低修复成本。
[1] 刘五星, 骆永明, 滕应, 等. 我国部分油田土壤及油泥的石油污染初步研究[J]. 土壤, 2007, 39(2):247-251.
[2] LIANG C J, BRUELL C J, MARLEY M C, et al. Persulfate oxidation for in situ remediation of TCE. Ⅱ. Activated by chelated ferrous ion[J]. Chemosphere, 2004, 55(9):1225-1234.
[3] GARRIDO-RAM REZ E G, THENG B K G, MORA M L. Clays and oxide minerals as catalysts and nanocatalysts in Fenton-like reactions: a review[J]. Applied Clay Science, 2010, 47(3/4): 182-192.
REZ E G, THENG B K G, MORA M L. Clays and oxide minerals as catalysts and nanocatalysts in Fenton-like reactions: a review[J]. Applied Clay Science, 2010, 47(3/4): 182-192.
[4] RASTOGI A, AL-ABED S R, DIONYSIOU D D. Effect of inorganic, synthetic and naturally occurring chelating agents on Fe(Ⅱ) mediated advanced oxidation of chlorophenols[J]. Water Research, 2009, 43(3): 684-694.
[5] TSITONAKI A, PETRI B, CRIMI M, et al. In situ chemical oxidation of contaminated soil and groundwater using persulfate: a review[J]. Critical Reviews in Environmental Science and Technology, 2010, 40(1): 55-91.
[6] LIANG C, SU H W. Identification of sulfate and hydroxyl radicals in thermally activated persulfate[J]. Industrial & Engineering Chemistry Research, 2009, 48(11): 5558-5562.
[7] 吴昊, 孙丽娜, 王辉, 等.CaO2/Fe2+活化过硫酸钠对石油类污染土壤的修复效果[J].环境化学, 2016, 35(4):623-628.
[8] 徐金兰, 宋少花, 黄廷林, 等. 柠檬酸改性 Fenton 氧化石油污染土壤的影响因素研究[J]. 西安建筑科技大学学报(自然科学版), 2015, 47(4):605-608.
[9] 张译之, 贾汉忠, 汪立今. Fe2+活化过硫酸盐在石油污染土壤中修复实验研究[J]. 岩石矿物学杂志, 2017, 36(6):881-886.
[10] 江闯, 赵宁华, 魏宏斌, 等. 类芬顿氧化法处理TPH污染土壤的试验研究[J]. 中国给水排水, 2018, 34(3): 97-99.
[11] 徐开泰, 林匡飞, 陆强, 等. 热活化过硫酸钠降解土壤体系中的菲[J]. 环境工程, 2018, 36(1):188-194.
[12] 陈玉, 任文会, 文国涛, 等. 化学氧化修复二甲四氯污染土壤研究[J]. 环境工程, 2016,34(增刊1):1008-1011.
[13] 朱杰, 罗启仕, 郭琳, 等. 碱热活化过硫酸盐氧化水中氯苯的试验[J]. 环境化学, 2013,32(12):2256-2262.
[14] 杨玲引, 宜慧, 常波,等. 柠檬酸改性Fenton氧化技术对陕北石油污染土壤的修复影响研究[J]. 应用化工, 2017,46(6):1118-1121.
[15] 吴昊, 孙丽娜, 李玉双,等. 活化过硫酸钠去除长期污染土壤中的TPH[J]. 环境工程学报, 2016, 10(9):5231-5237.
[16] LIANG C. Identification of active radical species in alkaline persulfate oxidation[J]. Water Environment Research, 2015, 87(7):656-659.
[17] 辛磊. 逐级Fenton化学氧化重度石油污染土壤的实验研究[D]. 西安:西安建筑科技大学, 2012.
[18] FANG G D, DIONYSIOU D, ZHOU D M. Transformation of polychlorinated biphenyls by persulfate at ambient temperature[J]. Chemosphere, 2013, 90(5): 1573-1580.
[19] FURMAN O S, TEEL A L, WATTS R J. Mechanism of base activation of persulfate[J]. Environmental Science and Technology, 2010, 44(16): 6423-6428.